Uued väljaanded
Oluline neuron, mis kontrollib liikumist ussides, avastati, mis on oluline inimese ravi jaoks
Viimati vaadatud: 02.07.2025

Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.

Sinai Healthi ja Toronto Ülikooli teadlased on avastanud pisikese ümarussi C. elegans'i närvisüsteemis mehhanismi, millel võib olla märkimisväärne mõju inimeste haiguste ravile ja robootika arendamisele.
Mei Zheni ja tema Lunenfeld-Tanenbaumi uurimisinstituudi kolleegide juhitud uuring avaldati ajakirjas Science Advances ning see paljastab spetsiifilise neuroni AVA võtmerolli ussi võime kontrollimisel edasi-tagasi liikumise vahel vahetada.
Usside jaoks on oluline roomata toiduallikate poole ja kiiresti ohu eest taganeda. See käitumine, kus need kaks tegevust on teineteist välistavad, on tüüpiline paljudele loomadele, sealhulgas inimestele, kes ei saa korraga istuda ja joosta.
Teadlased on pikka aega uskunud, et usside liikumise kontroll toimub kahe neuroni, AVA ja AVB, lihtsa interaktsiooni kaudu. Arvati, et esimene soodustab tagasi liikumist, teine edasi liikumist, kusjuures kumbki pärsib teist, et kontrollida liikumissuunda.
Zheni meeskonna uued andmed aga seavad selle seisukoha kahtluse alla, paljastades keerukama interaktsiooni, milles AVA neuronil on kahetine roll. See mitte ainult ei peata koheselt edasiliikumist AVB pärssimisega, vaid säilitab ka AVB pikaajalise stimulatsiooni, et tagada sujuv üleminek tagasi edasiliikumisele.
See avastus rõhutab AVA neuroni võimet peenhäälestada liikumist erinevate mehhanismide kaudu, olenevalt erinevatest signaalidest ja erinevatest ajakavadest.
„Inseneri vaatenurgast on see väga ökonoomne disain,“ ütleb Zheng, Toronto Ülikooli Temerty Meditsiinikooli molekulaargeneetika professor. „Tagasisideahela tugev ja püsiv pärssimine võimaldab loomal reageerida ebasoodsatele tingimustele ja põgeneda. Samal ajal pumpab kontrollneuron pidevalt gaasi edasiliikumisahelasse, et liikuda turvalistesse kohtadesse.“
Uuringut juhtinud Zhengi labori endine doktorant Jun Meng ütles, et loomade liikumise mõistmiseks ja neuroloogiliste häirete uurimiseks on oluline mõista, kuidas loomad selliste vastandlike motoorsete seisundite vahel liiguvad.
AVA neuroni domineeriva rolli avastamine pakub uusi teadmisi närviskeemide kohta, mida teadlased on uurinud alates tänapäevase geneetika tulekust enam kui pool sajandit tagasi. Zhengi labor kasutas edukalt tipptehnoloogiat, et täpselt moduleerida üksikute neuronite aktiivsust ja salvestada andmeid liikuvate elusate usside kohta.
Zhen, kes on ka Toronto Ülikooli kunstide ja teaduste teaduskonna raku- ja süsteemibioloogia professor, rõhutab selle uuringu interdistsiplinaarse koostöö olulisust. Meng viis läbi peamised katsed ning neuronite elektrilisi salvestusi tegi Bin Yu, doktorant Shangbang Gao laboris Huazhongi teadus- ja tehnoloogiaülikoolis Hiinas.
Tosif Ahmed, endine Zhengi labori järeldoktor ja nüüd HHMI Janelia uurimiskeskuse teooriateadlane USA-s, juhtis matemaatilist modelleerimist, mis oli oluline hüpoteeside testimiseks ja uute teadmiste saamiseks.
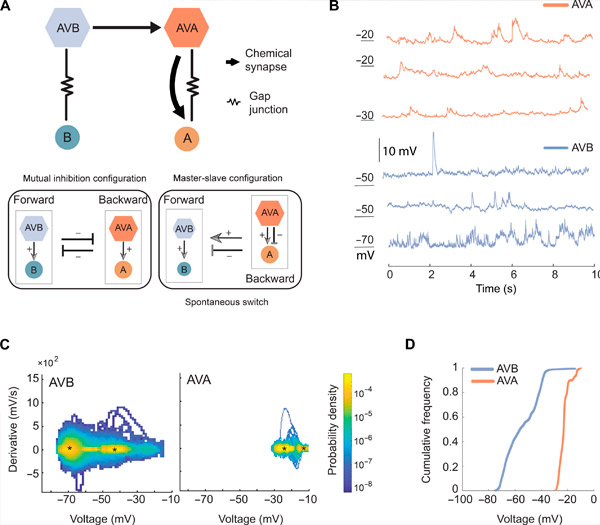
AVA-l ja AVB-l on erinevad membraanipotentsiaali vahemikud ja dünaamika. Allikas: Science Advances (2024). DOI: 10.1126/sciadv.adk0002
Uuringu tulemused pakuvad lihtsustatud mudelit neuronite liikumise kontrollimisel mitme rolli haldamise uurimiseks - kontseptsiooni, mida saaks rakendada ka inimese neuroloogiliste seisundite puhul.
Näiteks AVA kahetine roll sõltub selle elektrilisest potentsiaalist, mida reguleerivad selle pinnal olevad ioonkanalid. Zheng uurib juba, kuidas sarnased mehhanismid võivad olla seotud haruldase seisundiga, mida tuntakse CLIFAHDD sündroomina ja mis on põhjustatud sarnaste ioonkanalite mutatsioonidest. Uued leiud võivad anda teavet ka kohanemisvõimelisemate ja tõhusamate robotsüsteemide väljatöötamiseks, mis on võimelised sooritama keerukaid liigutusi.
„Alates tänapäeva teaduse algusest kuni tänapäeva tipptasemel uuringuteni on mudelorganismid, nagu C. elegans, mänginud olulist rolli meie bioloogiliste süsteemide keerukuse paljastamisel,“ ütles Anne-Claude Gingras, Lunenfeld-Tanenbaumi uurimisinstituudi direktor ja Sinai Healthi uuringute asepresident. „See uuring on suurepärane näide sellest, kuidas saame õppida lihtsatelt loomadelt ja rakendada neid teadmisi meditsiini ja tehnoloogia edendamiseks.“
