Uued väljaanded
Teadlased jälgivad varaseimaid füüsilisi muutusi rakkudes, mis põhjustavad vähki
Viimati vaadatud: 02.07.2025

Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
Kui vähk diagnoositakse, on rakulisel ja molekulaarsel tasandil juba palju märkamatult toimunud sündmusi. Kuigi kliinilistel eesmärkidel liigitatakse vähk varajaseks ja hiliseks staadiumiks, on isegi "varase" staadiumi kasvaja paljude varasemate kehas toimunud muutuste tagajärg, mida ei olnud võimalik tuvastada.
Nüüd on Yale'i ülikooli meditsiinikooli (YSM) teadlased ja nende kolleegid saanud üksikasjaliku ülevaate mõnest neist varajastest muutustest, kasutades võimsat kõrglahutusega mikroskoopiat, et jälgida hiire naharakkude esimesi vähki põhjustavaid füüsilisi muutusi.
Uurides hiiri, kellel oli mutatsioon, mis soodustab vähki juuksefolliikulites, leidsid teadlased, et esimesed vähi tekke tunnused ilmnevad hiirte juuksefolliikulite kasvus kindlal ajal ja kohas. Lisaks leidsid nad, et neid vähieelseid muutusi saab blokeerida ravimitega, mida tuntakse MEK inhibiitoritena.
Meeskonda juhtis Tianchi Xin, PhD, YSM-i geneetika osakonna teadur, ning sinna kuulusid Valentina Greco, PhD, YSM-i geneetikaprofessor ja Yale'i vähikeskuse ning Yale'i tüvirakkude keskuse liige, ning Sergi Regot, PhD, Johns Hopkinsi meditsiinikooli molekulaarbioloogia ja geneetika dotsent.
Nende uurimistöö tulemused avaldati ajakirjas Nature Cell Biology.
Teadlased uurisid hiiri, kellel tekib naha lamerakk-kartsinoom, mis on inimestel teine kõige levinum nahavähi tüüp. Neid hiiri geneetiliselt modifitseeriti vähki soodustava mutatsiooniga KRAS-geenis, mis on üks inimese vähkkasvajates enimmuteerunud onkogeene. KRAS-mutatsioone on leitud ka kopsu-, kõhunäärme- ja kolorektaalvähis.
Teadlaste uuritud varajaste muutuste hulka kuulus pisikese ebanormaalse muhukese kasv karvanääpsus, mida liigitatakse vähieelseks seisundiks. „Nende varajaste sündmuste mõistmine võib aidata meil välja töötada lähenemisviise vähi tekke ennetamiseks,“ ütles uuringu esimene autor Xin.
Kuigi nende uuring keskendub nahavähile, usuvad teadlased, et nende avastatud põhimõtteid saab rakendada paljude teiste KRAS-mutatsioonide põhjustatud vähivormide puhul, kuna nendes protsessides osalevad peamised geenid ja valgud on kasvajate lõikes samad.
Enam kui lihtsalt rakkude vohamine Nii inimestel kui ka hiirtel kasvavad juuksefolliikulid pidevalt, kaotades vanu juukseid ja moodustades uusi. Tüvirakkudel, millel on võime areneda erinevat tüüpi rakkudeks, on selles uuenemisprotsessis suur roll. Varasemad uuringud on näidanud, et KRAS-mutatsioonid põhjustavad juuksefolliikulites tüvirakkude vohamist ja arvati, et see tüvirakkude suur suurenemine põhjustab vähieelset koehaigust.
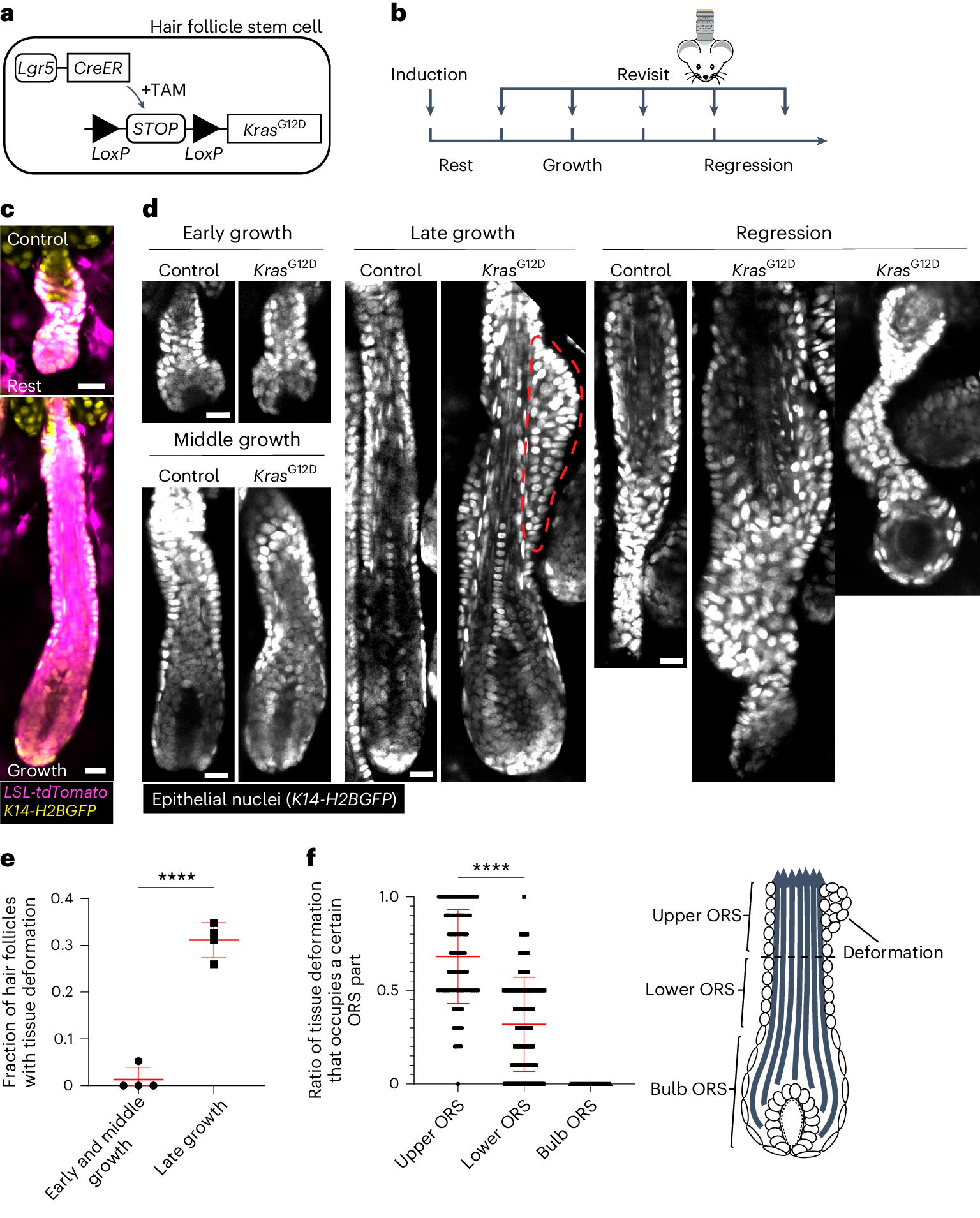
KrasG12D kutsub esile spetsiifilisi koedeformatsioone juuksefolliikulite regeneratsiooni ajal.
A. KrasG12D indutseerimise geneetilise lähenemisviisi skeem juuksefolliikulite tüvirakkudes, kasutades tamoksifeeniga indutseeritavat Cre-LoxP (TAM) süsteemi.
B. Skeem, mis näitab KrasG12D indutseerimise ja uuesti kuvamise ajastust juuksefolliikulite tsükli etappide suhtes.
C. Metsiktüüpi uinunud ja kasvavate juuksefolliikulite representatiivsed pildid, mis sisaldavad Cre-indutseeritavat tdTomato (Magenta) reporterit pärast indutseerimist.
D. Kontroll- ja KrasG12D juuksefolliikulite representatiivsed pildid juuksefolliikulite erinevates juuksetsükli etappides. Koedeformatsioon tuberkullitena välimises juuretupes (ORS) on näidatud punase punktiirjoonega.
E. Koedeformatsiooniga KrasG12D juuksefolliikulite osakaal juuksefolliikuli kasvu erinevates etappides.
F. Koedeformatsioonide osakaal ORS-i ülemises, alumises ja sibulakujulises osas üksikute KrasG12D juuksefolliikulite puhul.
Allikas: Nature Cell Biology (2024). DOI: 10.1038/s41556-024-01413-y
Selle idee testimiseks kasutas meeskond spetsiaalselt konstrueeritud muteerunud KRAS-i vormi, mida nad said aktiveerida kindlatel aegadel loomade karvanääpsude naharakkudes. Xin ja tema kolleegid kasutasid mikroskoopiatehnikat, mida tuntakse intravitaalse pildistamisena, mis võimaldab teha rakkudest in vivo kõrglahutusega pilte ning märgistada ja jälgida loomade üksikuid tüvirakke.
Kui KRAS-mutatsioon aktiveerus, hakkasid kõik tüvirakud kiiremini vohama, kuid vähieelne moodustis ainult ühes kindlas kohas juuksefolliikulis ja ühes kasvufaasis, mis tähendab, et rakkude arvu üldine suurenemine ei olnud tõenäoliselt kogu lugu.
KRAS-mutatsiooni aktiveerimine juuksefolliikulites põhjustas tüvirakkude kiirema proliferatsiooni, muutes nende migratsioonimustreid ja jagunedes erinevates suundades võrreldes rakkudega, millel vähki soodustavat mutatsiooni ei olnud.
Mutatsioon mõjutab valku, mida tuntakse ERK-na. Xin suutis jälgida ERK aktiivsust reaalajas elusloomade üksikute tüvirakkudes ja leidis selle valgu aktiivsuses spetsiifilise muutuse, mille põhjustas KRAS-mutatsioon. Teadlased suutsid ka MEK-i inhibiitori abil, mis blokeerib ERK aktiivsust, peatada vähieelse tüki moodustumise.
Ravim peatas mutatsiooni mõju rakkude migratsioonile ja orientatsioonile, kuid mitte üldisele tüvirakkude proliferatsioonile, mis tähendab, et eelvähilise seisundi teket juhivad need kaks esimest muutust, mitte suurenenud rakkude proliferatsioon.
Eelvähilised muutused kontekstis Onkogeense mutatsiooni mõju jälgimine reaalajas elusorganismis on ainus viis, kuidas teadlased on suutnud neid põhimõtteid paljastada. See on oluline, sest vähid ei teki vaakumis – nad sõltuvad kasvamiseks ja säilitamiseks suuresti oma mikrokeskkonnast. Teadlased pidid jälgima mitte ainult üksikute rakkude käitumist, vaid ka nende rakkude sees olevaid molekule.
„Meie lähenemisviis nende onkogeensete sündmuste mõistmiseks seisneb tegelikult tasanditeüleses ühendamises,“ ütles Greco. „Dr Xini ja dr Regoti kasutatud struktuur ja lähenemisviisid on võimaldanud meil minna molekulaarsete elementideni, ühendades need raku- ja koetasandiga, andes meile nende sündmuste lahendamise, mida on väljaspool elusorganismi nii raske saavutada.“
Nüüd tahavad teadlased jälgida protsessi pikema aja jooksul, et näha, mis juhtub pärast esialgse punni tekkimist. Samuti tahavad nad uurida teisi onkogeenseid sündmusi, näiteks põletikku, et näha, kas nende avastatud põhimõtted kehtivad ka teistes kontekstides.
