Uued väljaanded
ARID1A geeni mutatsioon muudab kasvajad immuunravi suhtes tundlikuks
Viimati vaadatud: 02.07.2025

Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
Immunoteraapia on viimastel aastatel vähiravis revolutsiooni teinud. Kasvajate otsese sihtimise asemel suunab immunoteraapia patsientide immuunsüsteemi kasvajaid tõhusamalt ründama. See on eriti efektiivne mõnede raskesti ravitavate vähivormide puhul. Siiski reageerib praegustele immunoteraapiatele vähem kui pool kõigist vähihaigetest, mistõttu on tungiv vajadus tuvastada biomarkerid, mis suudavad ennustada, millised patsiendid saavad ravist kõige rohkem kasu.
Hiljuti on teadlased märganud, et patsiendid, kelle kasvajatel on ARID1A geenis mutatsioon, reageerivad tõenäolisemalt positiivselt immuunkontrollpunkti blokaadile, mis on immunoteraapia tüüp, mis toimib vähivastaste immuunrakkude aktiveerimise teel.
Kuna ARID1A geenimutatsioon esineb paljudes vähivormides, sealhulgas endomeetriumi-, munasarja-, kolorektaalse-, mao-, maksa- ja kõhunäärmevähi puhul, mõtlesid Salki Instituudi teadlased, kuidas see võiks kaasa aidata ravi tundlikkusele ja kuidas arstid saaksid seda teavet kasutada iga patsiendi vähiravi isikupärastamiseks.
Nende uus uuring, mis avaldati ajakirjas Cell, näitab, et ARID1A mutatsioon muudab kasvajad immunoteraapia suhtes tundlikuks, värvates viirusevastase toimega sarnase immuunvastuse kaudu kasvajasse vähiga võitlevaid immuunrakke.
Teadlased pakuvad välja, et seda mutatsiooni ja viirusevastast immuunvastust saaks kasutada biomarkerina, et paremini valida patsiente spetsiifiliste immunoteraapiate, näiteks immuunsüsteemi kontrollpunktide blokeerimise jaoks. Need leiud soodustavad ka ravimite väljatöötamist, mis on suunatud ARID1A ja sellega seotud valkude vastu, et muuta teised kasvajad immunoteraapia suhtes tundlikumaks.
„See võib patsientide vähiravi tulemusi oluliselt muuta,“ ütles uuringu vanemautor, dotsent Diana Hargreaves. „ARID1A mutatsiooniga patsientidel on juba immuunvastus olemas, seega peame vaid seda vastust immuunsüsteemi kontrollpunktide blokeerimisega võimendama, et aidata neil oma kasvajaid seestpoolt hävitada.“
Kuigi oli teada, et ARID1A mutatsioonidega inimesed reageerisid immuunsüsteemi kontrollpunktide blokeerimisele hästi, jäi nende kahe vaheline täpne seos ebaselgeks. Mehhanismi valgustamiseks kasutasid Salki Instituudi teadlased melanoomi ja kolorektaalse vähi hiiremudeleid, millel oli nii ARID1A mutatsioon kui ka funktsionaalne ARID1A.
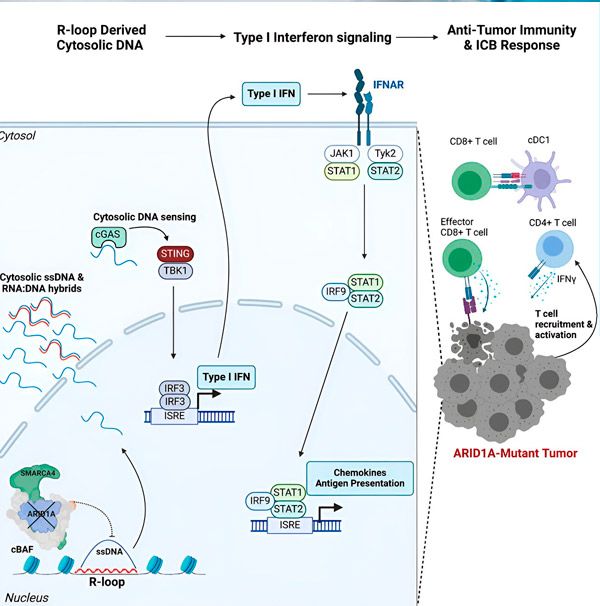
Allikas: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
Meeskond täheldas tugevat immuunvastust kõigis ARID1A mutatsiooniga mudelites, kuid mitte neis, kus ARID1A oli funktsionaalne, mis toetab ideed, et ARID1A mutatsioon tõepoolest seda vastust põhjustab. Aga kuidas see molekulaarsel tasandil toimib?
„Leidsime, et ARID1A mängib tuumas olulist rolli, säilitades DNA õige organisatsiooni,“ ütleb Matthew Maxwell, uuringu esimene autor ja Hargreavesi labori magistrant. „Ilma funktsionaalse ARID1A-ta saab vaba DNA-d eemaldada ja tsütosooli vabastada, aktiveerides soovitava viirusevastase immuunvastuse, mida saab immuunsüsteemi kontrollpunktide blokeerimisega võimendada.“
ARID1A geen kodeerib valku, mis aitab reguleerida meie DNA kuju ja säilitada genoomi stabiilsust. Kui ARID1A muteerub, käivitab see vähirakkudes Rube Goldbergi-laadse sündmuste ahela.
Esiteks vabaneb ARID1A funktsioneerimise puudumine DNA-d tsütosooli. Seejärel aktiveerib tsütosoolne DNA viirusevastase häiresüsteemi, cGAS-STING raja, kuna meie rakud on kohastunud märgistama tsütosoolis olevat DNA-d võõrana, et kaitsta viirusnakkuste eest. Lõppkokkuvõttes kaasab cGAS-STING rada immuunsüsteemi, et värvata T-rakke kasvajasse ja aktiveerida need spetsialiseerunud vähivastasteks T-rakkudeks.
Igas etapis, mis sõltub eelmisest, viib see sündmusteahel – ARID1A mutatsioon, DNA põgenemine, cGAS-STING häire, T-rakkude värbamine – vähiga võitlevate T-rakkude arvu suurenemiseni kasvajas. Seejärel saab immuunsüsteemi kontrollpunktide blokeerimist kasutada selleks, et tagada nende T-rakkude aktiveerumine, suurendades nende võimet vähki võita.
„Meie tulemused pakuvad uut molekulaarset mehhanismi, mille abil ARID1A mutatsioon võib kaasa aidata kasvajavastasele immuunvastusele,“ ütleb Hargreaves. „Nende leidude juures on põnev just translatsiooniline potentsiaal. Saame ARID1A mutatsioone kasutada patsientide valimiseks immuunsüsteemi kontrollpunktide blokeerimiseks ning näeme nüüd mehhanismi, mille abil ARID1A-d või selle valgukompleksi inhibeerivaid ravimeid saaks kasutada immunoteraapia edasiseks täiustamiseks teistel patsientidel.“
Kirjeldades mehhanismi, mille abil immuunsüsteemi kontrollpunktide blokeerimine on ARID1A mutatsiooniga vähivormide korral efektiivsem, pakuvad teadlased arstidele põhjenduse selle immunoteraapia prioriseerimiseks ARID1A mutatsiooniga patsientidele. Need leiud on oluline samm vähiravi isikupärastamise suunas ja inspireerivad uute ravimeetodite väljatöötamist, mis on suunatud ARID1A ja selle valgukompleksi vastu.
Edaspidi loodab Salki Instituudi meeskond, et nende tulemused parandavad ARID1A mutatsioonidega seotud erinevat tüüpi vähiga patsientide ravitulemusi ning kavatseb uurida seda kliinilist tõlget koostöös California Ülikooliga San Diegos.
