Uued väljaanded
LM11A-31 ravim aeglustab Alzheimeri tõve progresseerumist uuringus
Viimati vaadatud: 02.07.2025

Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.

Hiljutises ajakirjas Nature Medicine avaldatud uuringus viisid teadlased läbi randomiseeritud, topeltpime, platseebokontrolliga 2a faasi uuringu, et uurida LM11A-31 ohutust ja efektiivsust Alzheimeri tõve (AT) ravis p75 neurotrofiini retseptori (p75NTR) moduleerimise kaudu.
Hiline Alzheimeri tõbi on dementsuse kõige levinum vorm, mida iseloomustab sünaptilise puudulikkuse, degeneratsiooni ja närvirakkude kadu. Kuigi kaks peamist Alzheimeri tõve ravimit on suunatud ebanormaalsete amüloid-β või tau valkude kogunemisele, mõjutavad need ainult osa patofüsioloogiast. Teine lähenemisviis hõlmab retseptorite ja signaaliülekande võrgustike sihtimist, mis mõjutavad fundamentaalseid bioloogilisi radasid. Prekliinilised uuringud näitavad, et p75NTR moduleerimine uudse väikese keemilise molekuliga LM11A-31 vähendab amüloidi ja ebanormaalse tau põhjustatud sünaptilise kadu.
Uuringu kirjeldus
Selles randomiseeritud kliinilises uuringus uurisid teadlased, kas LM11A-31 võib inimestel p75NTR-i moduleerimise teel aeglustada Alzheimeri tõve progresseerumist.
Uuringus osalejatele manustati 26 nädala jooksul 242 kerge kuni mõõduka astmaga patsiendile LM11A-31 suukaudseid kapsleid annustes 200 mg ja 400 mg või platseebot vahekorras 1:1:1. Osalejatel oli bioloogiliselt kinnitatud Alzheimeri tõbi (tserebrospinaalvedeliku amüloid β-valgu 42 (Aβ42) tase alla 550 ng/l või Aβ42:β40 suhe alla 0,89), mis oli diagnoositud McKhanni kriteeriumide alusel, minipsühhiaatrilise uuringu (MMSE) skooriga 18–26, geriaatrilise depressiooni skaala (GDS) skooriga alla 5,0, modifitseeritud Hachinski isheemilise skaala (HIS) skooriga ≤ 4,0, formaalse haridusega ≥ 8 aastat ja varasema kognitiivse langusega ≥ 6 kuud.
Abikõlblikud osalejad olid enne uuringusse sisenemist võtnud atsetüülkoliinesteraasi inhibiitoreid (AChEI-sid) või osalisi NMDA retseptori antagoniste ≥ 3 kuud. Nad ei võtnud illegaalseid narkootikume, nagu antipsühhootikumid, bensodiasepiinid, epilepsiavastased ravimid, rahustid, tsentraalselt toimivad antihüpertensiivsed ravimid, nootroopikumid (välja arvatud hõlmikpuu) ega opioide sisaldavad valuvaigistid.
Uuringu peamine tulemusnäitaja oli ohutus ja talutavus, mida hinnati Columbia suitsiidimõtete ja käitumise raskusastme hindamisskaala (C-SSRS) abil, elutähtsate näitajate, vererõhu ja hematoloogiliste parameetrite abil. Teisese kognitiivse tulemuse hindamiseks kasutati struktuurset magnetresonantstomograafiat (cMRI), fluorodeoksüglükoosi positronemissioontomograafiat (FDG-PET) ja tserebrospinaalvedeliku (CSF) biomarkereid. Alzheimeri tõve näitajate hulka kuulusid Thr181-fosforüülitud tau, tau valgu koguhulk, Aβ40, Aβ42 ja AChE aktiivsus. Meeskond kasutas kohandatud neuropsühholoogilist testi, et hinnata teisese kognitiivse tulemuse algtasemel, 12. ja 26. nädalal.
Uurimistulemused
Uuringus leiti, et LM11A-31 on ohutu ja hästi talutav ning olulisi ohutusprobleeme ei esinenud. Kõige sagedasemate kõrvaltoimete hulka kuulusid peavalu, kõhulahtisus, eosinofiilia ja nasofarüngiit, kusjuures seedetrakti probleemid ja eosinofiilia olid peamised katkestamise põhjused. 400 mg rühmas oli ravi katkestamisi rohkem kui 200 mg ja platseeborühmas. MRI ei näidanud ohutusprobleeme, sh amüloidiga seotud kõrvalekaldeid. Kahe ravirühma vahel ei olnud kognitiivsete skooride ega amüloidiga seotud kõrvalekallete osas olulisi erinevusi.
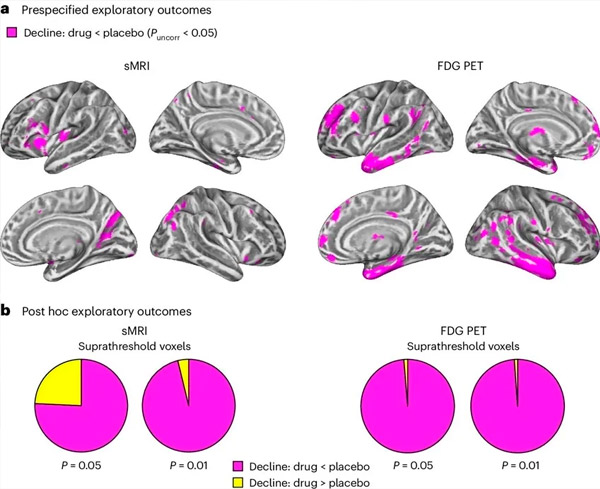
A. Kahesuunaline segamudelite kovariatsioonianalüüs uuris ravi (ravim või platseebo) ja aja (enne või pärast ravi) vahelisi koostoimeid. Ühesuunaline t-kontrastanalüüs interaktsioonihüpoteesi (ravim aeglustab progresseerumist võrreldes platseeboga) uurimisel näitas, et LM11A-31 ravi aeglustas pikisuunalist degeneratsiooni (vasakpoolsed paneelid) ja glükoosi hüpometabolismi (parempoolsed paneelid) ravimirühmas (cMRI, n = 127; PET, n = 121) võrreldes platseeborühmaga (cMRI, n = 66; PET, n = 62). Seda interaktsiooni näitavad vokselid on näidatud korrigeerimata lävel P < 0,05 (magenta) populatsioonispetsiifilisel ajukoore pinnal. Vasak ja parem poolkera on näidatud vastavalt ülemises ja alumises reas. Aju piirkonnad, mis näitavad hüpoteesiga vastuolus olevaid interaktsioone, on näidatud lisaandmete joonisel 7.
B. Vokselite koguarv eelnevalt määratletud haavatavates Alzheimeri tõvega ajupiirkondades (sektordiagrammide kogupindala), mis näitavad kas hüpoteesiga kooskõlas olevat interaktsiooni (magenta) või hüpoteesiga vastuolus olevat interaktsiooni (kollane) igas pildistamisviisis (cMRI, vasak paneel; FDG PET, parem paneel) üha liberaalsemate korrigeerimata läviväärtuste P < 0,01 ja P < 0,05 juures. Monte Carlo simulatsioonid näitasid, et hüpoteesiga kooskõlas olevate ja hüpoteesiga vastuolus olevate efektidega vokselite suhtarvud olid oluliselt kõrgemad kui nii cMRI kui ka PET juhuslikult genereeritud andmete põhjal täheldatud (P < 0,001 iga modaalsuse kohta; kahesuunaline test).
LM11A-31 vähendas efektiivselt tserebrospinaalvedelikus Aβ42 ja Aβ40 suurenemist platseeborühmaga võrreldes. Ravim näitas ka presünaptilise valgu biomarkeri SNAP25 mediaanse aastase protsentuaalse muutuse vähenemist ja postsünaptilise biomarkeri NG vähenemist, mis viitab presünaptiliste ja postsünaptiliste ühenduste kadumise aeglustumisele. LM11A-31 vähendas ka YKL40 suurenemist, mis viis MMSE skooride vähenemiseni ja ADAS-Cog-13 skooride suurenemiseni. Ravim vähendas ka halli aine kadu otsmikusagaras ja tagumises parietaalkoortes ning glükoosi metabolismi vähenemist sellistes piirkondades nagu entorhinaalne korteks, temporaalne korteks, hipokampus, saareline korteks ja prefrontaalne korteks.
Kokkuvõte
Uuringus jõuti järeldusele, et p75NTR-i moduleerimine LM11A-31 poolt sobib suuremate kliiniliste uuringute jaoks. LM11A-31 vastas esmasele ohutuse tulemusnäitajale ja oli kerge kuni raske Alzheimeri tõvega patsientidel hästi talutav. Tulemused näitavad vajadust edasiste uuringute järele, kus ravi kestaks kauem, et hinnata väikeste molekulide potentsiaali reguleerida p75NTR-i haigust modifitseeriva ravina Alzheimeri tõve korral. Uuring näitas, et LM11A-31 mõjutas oluliselt mitmeid biomarkereid, sealhulgas Aβ40, Aβ42, SNAP25, NG ja YKL40, mis viitab patoloogilise progresseerumise aeglustumisele. Edasised uuringud võivad hinnata gliaalrakkude tervise täiendavaid näitajaid.
