Uued väljaanded
FDA poolt heaks kiidetud TIVDAK®: koefaktori sihtmärgiks emakakaelavähi puhul
Viimati vaadatud: 02.07.2025

Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
29. aprillil 2024 andis USA Toidu- ja Ravimiamet (FDA) Seagen Inc.-i ravimile TIVDAK® (tisotumab-vedotiin), mis on koefaktorit (TF) sihtiv ravim, täieliku heakskiidu korduva või metastaatilise emakakaelavähi raviks patsientidel, kellel onkeemiaravi ajal või pärast seda progresseerunud haigus. See kujutab endast olulist läbimurret emakakaelavähi ravis, rõhutades antikehade ja ravimikonjugaatide (ADC-de) potentsiaali onkoloogias.
TIVDAKi toimemehhanism
Tivdak on antitrombinoüülitud antikeha (ADC), mis toimib TF-i vastu, kombineerides Genmabi TF-vastase monoklonaalse antikeha tisotumabi Seageni ADC-tehnoloogiaga, mis on loodud TF-i antigeenide sihtimiseks vähirakkudel ja tsütotoksilise komponendi MMAE otse vähirakkudesse toimetamiseks.
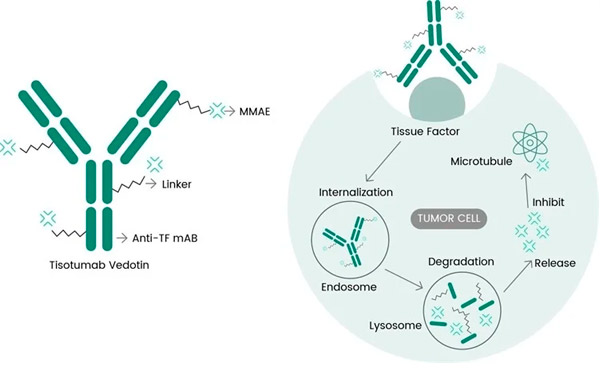
Tisotumab-vedotiini molekulaarne toimemehhanism ( https://doi.org/10.3390/ijms23073559 )
TF: ideaalne sihtmärk ADC arendamiseks
TF on teadaolevalt seotud kasvaja signaaliülekande ja angiogeneesi protsessidega ning seda ekspresseeritakse üle enamikul emakakaelavähi ja paljude teiste tahkete kasvajatega patsientidest. Selle võime antikehade sidumisel kiiresti omastada ja minimaalne mõju normaalsele vere hüübimisele suurendab veelgi selle sobivust sihipäraseks vähiraviks.
