LM11A-31 ravim aeglustab uuringus Alzheimeri tõve progresseerumist
Viimati vaadatud: 14.06.2024

Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.

Ajakirjas Nature Medicine avaldatud hiljutises uuringus viisid teadlased läbi randomiseeritud topeltpime platseebokontrolliga faasi 2a uuringu, et uurida LM11A-31 ohutust ja efektiivsust Alzheimeri tõve (AD) ravis. P75 neurotrofiini retseptori (p75NTR) moduleerimine.
Hilja algusega AD on kõige levinum dementsuse vorm, mida iseloomustab sünaptiline rike, degeneratsioon ja närvirakkude kadu. Kuigi kaks peamist AD raviks kasutatavat ravimit on suunatud ebanormaalse amüloid-β või tau valgu kogunemisele, käsitlevad need ainult osa patofüsioloogiast. Teine lähenemisviis on sihtida retseptoreid ja signaalivõrke, mis mõjutavad põhilisi bioloogilisi teid. Prekliinilised uuringud näitavad, et p75NTR moduleerimine uudse väikese molekuliga LM11A-31 vähendab amüloidi ja patoloogilise tau põhjustatud sünaptilist kadu.
Uuringu kirjeldus
Selles randomiseeritud kliinilises uuringus uurisid teadlased, kas LM11A-31 võib inimestel p75NTR-i moduleerimise kaudu aeglustada Alzheimeri tõve progresseerumist.
Uuringus osalejatele manustati 242 kerge kuni mõõduka astmaga patsiendile 26 nädala jooksul suukaudseid LM11A-31 kapsleid annustes 200 mg ja 400 mg või platseebot vahekorras 1:1:1. Osalejatel oli bioloogiliselt kinnitatud Alzheimeri tõbi (tserebrospinaalvedeliku amüloidi β-valgu 42 (Aβ42) tase alla 550 ng/l või Aβ42:β40 suhe alla 0,89), diagnoositud McKhanni kriteeriumide järgi, Mini Psychiatric SE (MMSE) skooriga 26,18 kuni 18. Geriaatrilise depressiooni skaala (GDS) hinded alla 5,0, modifitseeritud Hacinski isheemilise skaala (HIS) skoorid ≤ 4,0, formaalne haridus ≥ 8 aastat ja varasem kognitiivne langus ≥ 6 kuud.
Sobilikud osalejad olid võtnud atsetüülkoliinesteraasi inhibiitoreid (AChEI) või osalisi NMDA retseptori antagoniste ≥ 3 kuud enne uuringusse sisenemist. Nad ei võtnud keelatud ravimeid, nagu antipsühhootikumid, bensodiasepiinid, epilepsiavastased ravimid, rahustid, tsentraalselt aktiivsed antihüpertensiivsed ravimid, nootroopsed ravimid (va hõlmikpuu) ega opioide sisaldavaid valuvaigisteid.
Uuringu esmane tulemus oli ravimite ohutus ja talutavus, mida hinnati Columbia suitsiidimõtete ja -käitumise tõsiduse hindamisskaala (C-SSRS), elutähtsate näitajate, vererõhu ja hematoloogiliste parameetrite järgi. Sekundaarsete kognitiivsete tulemuste hindamiseks kasutati struktuurset magnetresonantstomograafiat (sMRI), fluorodeoksüglükoosi positronemissioontomograafiat (FDG-PET) ja tserebrospinaalvedeliku (CSF) biomarkereid. AD indikaatorite hulka kuulusid Thr181 juures fosforüülitud tau, kogu tau valk, Aβ40, Aβ42 ja AChE aktiivsus. Töörühm kasutas individuaalset neuropsühholoogilist testi, et hinnata sekundaarseid kognitiivseid tulemusi algtasemel, 12. Ja 26. Nädalal.
Uurimistulemused
Uuring näitas, et LM11A-31 oli ohutu ja hästi talutav, ilma märkimisväärsete ohutusprobleemideta. Kõige sagedasemad kõrvalnähud olid peavalu, kõhulahtisus, eosinofiilia ja nasofarüngiit, kusjuures ravimi kasutamise katkestamise peamised põhjused olid seedetrakti probleemid ja eosinofiilia. 400 mg rühmas katkestati ravi rohkem kui 200 mg ja platseebo rühmas. MRI ei näidanud ravimiohutusega seotud probleeme, sealhulgas amüloidiga seotud kõrvalekaldeid. Kahe ravirühma vahel ei olnud olulisi erinevusi kognitiivsete skooride ega amüloidi kõrvalekallete osas.
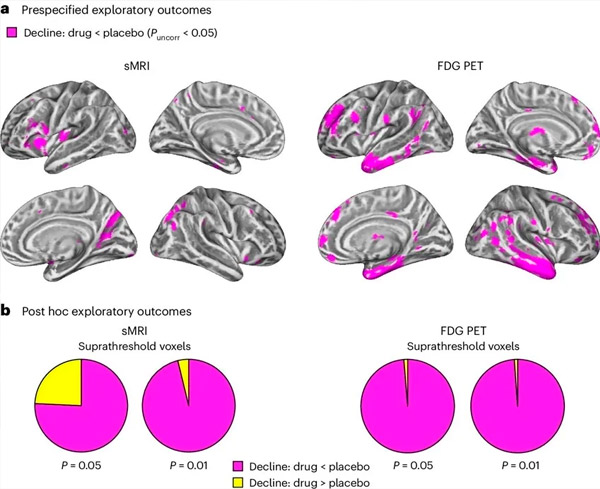
A. Kovariatsiooni kahefaktorilise segamudeli analüüsides uuriti koostoimeid ravi (ravim või platseebo) ja aja (enne või pärast ravi) vahel. Ühesuunaline t-kontrast, mis uuris koostoime hüpoteesi (ravim aeglustab progresseerumist võrreldes platseeboga), näitas, et ravi LM11A-31-ga aeglustas ravimiga ravitud rühmas (cMRI, n =) pikisuunalist degeneratsiooni (vasakpoolsed paneelid) ja glükoosi hüpometabolismi (parempoolne paneel). 127 PET, n = 121), võrreldes platseeborühmaga (sMRI, n = 66; PET, n = 62). Seda interaktsiooni näitavad vokslid on näidatud korrigeerimata läve P < 0,05 (magenta värv) populatsioonispetsiifilisel kortikaalsel pinnal. Vasak ja parem poolkera on näidatud vastavalt ülemises ja alumises reas. Ajupiirkonnad, mis näitavad hüpoteesiga vastuolus olevaid interaktsioone, on näidatud lisaandmete joonisel 7.
b. Vokslite koguarv eelnevalt määratletud haavatavates AD ajupiirkondades (sektordiagrammide kogupindala), mis näitavad kas hüpoteesiga järjekindlat interaktsiooni (magent värv) või hüpoteesiga vastuolus olevat interaktsiooni (kollane värv) igas pildistamisviisis (cMRI, vasak paneel; FDG PET, parem paneel) järjest liberaalsema reguleerimata P-läve juures < 0,01 ja P < 0,05. Monte Carlo simulatsioonid näitasid, et hüpoteesiga kooskõlas olevate vokslite ja hüpoteesiga mittevastavate vokslite suhted olid oluliselt kõrgemad kui need, mida täheldati juhuslikult genereeritud andmete põhjal nii cMRI kui ka PET jaoks (P
LM11A-31 vähendas tõhusalt Aβ42 ja Aβ40 suurenemist CSF-is võrreldes platseeborühmaga. Ravim näitas ka presünaptilise valgu biomarkeri SNAP25 keskmise aastase protsendimuutuse vähenemist ja postsünaptilise biomarkeri NG vähenemist, mis näitab presünaptiliste ja postsünaptiliste ühenduste kadumise aeglustumist. LM11A-31 vähendas ka YKL40 kasvu, mille tulemuseks oli MMSE skoori vähenemine ja ADAS-Cog-13 skoori suurenemine. Ravim vähendas ka hallaine kadu otsmikusagaras ja tagumises parietaalkoores ning glükoosi metabolismi sellistes piirkondades nagu entorhinaalne ajukoor, temporaalne ajukoor, hipokampus, saarekoor ja prefrontaalne ajukoor.
Järeldus
Uuringus jõuti järeldusele, et p75NTR moduleerimine LM11A-31 poolt sobib suuremateks kliinilisteks uuringuteks. LM11A-31 vastas esmasele ohutuskriteeriumile ja seda talusid hästi kergete kuni raskete astmavormidega patsiendid. Tulemused näitavad, et on vaja täiendavaid uuringuid pikema ravi kestusega, et hinnata väikeste molekulide kasutamise teostatavust p75NTR reguleerimiseks AD haigust modifitseeriva ravina. Uuringus leiti, et LM11A-31 mõjutas oluliselt mitmeid biomarkereid, sealhulgas Aβ40, Aβ42, SNAP25, NG ja YKL40, mis viitab patoloogilise arengu nõrgenemisele. Tulevased uuringud võivad hinnata täiendavaid gliia tervise näitajaid.
