Uued väljaanded
Osteoporoosi korral luumassi vähenemise vältimiseks tuvastatud võtmevalku
Viimati vaadatud: 02.07.2025

Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
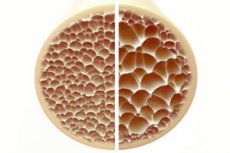
Osteoporoos, seisund, mida iseloomustavad poorsed ja haprad luud, kujutab endast märkimisväärset ohtu luustiku tervisele. Luud kui inimkeha peamine tugistruktuur pakuvad elutähtsat tuge. Kui luumass väheneb, kahjustab see mitte ainult seda tuge, vaid ka üldist funktsiooni, mis viib elukvaliteedi languseni.
Kuna osteoporoosi esinemissagedus vananevas elanikkonnas suureneb, suureneb ka pikaajalise ravi tervishoiuressursside koormus. Seetõttu on vaja mõista osteoporoosi arengut soodustavaid mehhanisme ja töötada välja tõhusad sihipärased ravimeetodid, et minimeerida selle pikaajalist mõju.
Osteoblastid ja osteoklastid on kahte tüüpi rakke, millel on võtmeroll luukoe säilitamisel ja ümberkujundamisel. Kui osteoblastid on luu moodustavad rakud, mis vastutavad uue luukoe sünteesi ja ladestumise eest, siis osteoklastid on luu lagundavad rakud, mis osalevad vana või kahjustatud luukoe lagundamisel ja eemaldamisel.
Osteoklastide osakaalu suurenemine põhjustab luukadu selliste seisundite korral nagu osteoporoos, reumatoidartriit (liigeste põletik) ja luumetastaasid (luudesse levinud vähk). Osteoklastid tekivad makrofaagide või monotsüütide, mis on teatud tüüpi immuunrakud, diferentseerumisest.
Seega võib osteoklastide diferentseerumise pärssimine olla luukadu ennetamise terapeutiline strateegia. Siiski on luude ümberehituse keerulist protsessi reguleerivad täpsed molekulaarsed mehhanismid ebaselged.
Uues uuringus uurisid Tokyo Teadusülikooli professor Tadayoshi Hayata, hr Takuto Konno ja pr Hitomi Murachi koos kolleegidega osteoklastide diferentseerumise molekulaarset regulatsiooni. Tuumafaktori kappa B ligandi (RANKL) retseptori aktivaatoriga stimuleerimine kutsub esile makrofaagide diferentseerumise osteoklastideks.
Lisaks on RANKL-vahendatud osteoklastide diferentseerumise regulatsioonis seostatud luu morfogeneetilise valgu (BMP) ja transformeeriva kasvufaktori (TGF)-β signaaliülekande radasid. Käesolevas uuringus püüdsid teadlased uurida Ctdnep1 rolli, mis on fosfataas (ensüüm, mis eemaldab fosfaatrühmi), mille kohta on teatatud, et see pärsib BMP ja TGF-β signaaliülekande radasid.
Uuring avaldati ajakirjas Biochemical and Biophysical Research Communications.
Professor Hayata väidab: "RANKL toimib osteoklastide diferentseerumise "kiirendina". Auto juhtimine nõuab lisaks gaasipedaalile ka pidureid. Siin leidsime, et Ctdnep1 toimib osteoklastide diferentseerumise "pidurina"."
Teadlased uurisid esmalt Ctdnep1 ekspressiooni RANKL-iga töödeldud hiire makrofaagides ja töötlemata kontrollrakkudes. Nad täheldasid, et Ctdnep1 ekspressioon ei muutunud vastusena RANKL-i stimulatsioonile. Küll aga lokaliseerus see makrofaagides graanulites tsütoplasmas ja diferentseerus osteoklastideks, erinevalt selle normaalsest perinukleaarsest lokalisatsioonist teistes rakutüüpides, mis viitab selle tsütoplasmaatilisele funktsioonile osteoklastide diferentseerumisel.
Lisaks põhjustas Ctdnep1 pärssimine (geeniekspressiooni allareguleerimine) tartraadiresistentse happefosfataasi (TRAP) suhtes positiivsete osteoklastide arvu suurenemise, kus TRAP on diferentseerunud osteoklastide marker.
Ctdnep1 väljalülitamine tõi kaasa peamiste diferentseerumismarkerite, sealhulgas "Nfatc1", RANKL-i poolt osteoklastide diferentseerumiseks indutseeritud peamise transkriptsioonifaktori, ekspressiooni suurenemise. Need tulemused toetavad Ctdnep1 "pidurdusfunktsiooni", mille kohaselt see reguleerib negatiivselt osteoklastide diferentseerumist. Lisaks tõi Ctdnep1 väljalülitamine kaasa ka kaltsiumfosfaadi imendumise suurenemise, mis viitab Ctdnep1 pärssivale rollile luu resorptsioonis.
Lõpuks, kuigi Ctdnep1 väljalülitamine ei muutnud BMP ja TGF-β signaaliülekannet, näitasid Ctdnep1-defitsiitsed rakud suurenenud fosforüülitud (aktiveeritud) valkude taset, mis on RANKL signaaliülekande raja produktid. Need tulemused viitavad sellele, et Ctdnep1 inhibeeriv toime osteoklastide diferentseerumisele ei pruugi olla vahendatud BMP ja TGF-β signaaliülekande kaudu, vaid RANKL signaaliülekande raja ja Nfatc1 valgu taseme languse kaudu.
Kokkuvõttes annavad need tulemused uut teavet osteoklastide diferentseerumisprotsessi kohta ja tuvastavad potentsiaalseid terapeutilisi sihtmärke, mida saaks kasutada osteoklastide üliaktiivsusest tingitud luukadu vähendamiseks mõeldud ravimeetodite väljatöötamiseks. Lisaks luukaduga iseloomustatud haigustele on Ctdnep1 tuvastatud ka medulloblastoomi, laste ajukasvaja, põhjusliku tegurina. Autorid on optimistlikud, et nende uuringuid saab laiendada ka teistele inimeste haigustele peale luu ainevahetuse.
Professor Hayata järeldab: "Meie tulemused näitavad, et Ctdnep1 on vajalik liigse osteoklastogeneesi vältimiseks. Need tulemused võivad veelgi laiendada meie teadmisi selle kohta, kuidas fosforüülimise-defosforüülimise võrgustik kontrollib osteoklastide diferentseerumist ja pakkuda uusi ravistrateegiaid liigse osteoklastide aktiivsusega seotud luuhaiguste raviks."
