Uued väljaanded
Suletud ahelaga ravimi manustamissüsteem võib parandada keemiaravi manustamist
Viimati vaadatud: 02.07.2025

Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
Kui vähihaiged saavad keemiaravi, arvutatakse enamiku ravimite annused patsiendi kehapindala põhjal. See hinnatakse võrrandi abil, mis võtab arvesse patsiendi pikkust ja kaalu. See võrrand koostati 1916. aastal vaid üheksa patsiendi andmete põhjal.
See lihtsustatud doseerimisviis ei võta arvesse teisi tegureid ja võib põhjustada olukorra, kus patsiendile manustatakse liiga palju või liiga vähe ravimit. Selle tulemusena võivad mõned patsiendid kogeda keemiaravi tarbetut toksilisust või ebapiisavat efektiivsust.
Keemiaravi annustamise täpsuse parandamiseks on MIT insenerid välja töötanud alternatiivse lähenemisviisi, mis võimaldab annust iga patsiendi jaoks isikupärastada. Nende süsteem mõõdab ravimi kogust patsiendi kehas ja edastab need andmed kontrollerisse, mis saab infusioonikiirust vastavalt reguleerida.
Teadlaste sõnul aitaks see lähenemisviis kompenseerida ravimite farmakokineetika erinevusi, mis on põhjustatud keha koostisest, geneetilisest eelsoodumusest, keemiaravist põhjustatud organitoksilisusest, koostoimetest teiste ravimite ja toiduga ning keemiaravi ravimite lagundamise eest vastutavate ensüümide ööpäevastest kõikumistest.
„Tunnistades edusamme ravimite metabolismi mõistmisel ja rakendades inseneritööriistu personaalse annustamise lihtsustamiseks, usume, et saame aidata muuta paljude ravimite ohutust ja efektiivsust,“ ütles Giovanni Traverso, MIT masinaehituse dotsent, Brighami ja naistehaigla gastroenteroloog ning uuringu vanemautor.
Ajakirjas Med avaldatud artikli juhtiv autor on MIT-i magistrant Louis DeRidder.
Pidev jälgimine
Selles uuringus keskendusid teadlased ravimile nimega 5-fluorouratsiil, mida kasutatakse kolorektaalse vähi ja teiste vähivormide raviks. Ravimit manustatakse tavaliselt 46 tunni jooksul ja selle annus määratakse patsiendi pikkuse ja kaalu põhjal arvutatud valemi abil, mis annab hinnangu kehapindala kohta.
See lähenemisviis ei võta aga arvesse keha koostise erinevusi, mis võivad mõjutada ravimi jaotumist organismis, ega geneetilisi variatsioone, mis mõjutavad selle metabolismi. Need erinevused võivad põhjustada kahjulikke kõrvaltoimeid, kui manustatakse liiga palju ravimit. Kui ravimit ei manustata piisavalt, ei pruugi see kasvajat oodatud viisil hävitada.
„Sama kehapindalaga inimestel võib olla väga erinev pikkus ja kaal, erinev lihasmass või erinev geneetika, aga seni, kuni sellesse võrrandisse ühendatud pikkus ja kaal annavad sama kehapindala, on nende annus identne,“ ütleb DeRidder, Harvardi-MITi terviseteaduste ja -tehnoloogia programmi meditsiinitehnika ja meditsiinifüüsika doktorant.
Teine tegur, mis võib muuta ravimi hulka veres igal ajahetkel, on ensüümi dihüdropürimidiindehüdrogenaas (DPD) ööpäevane varieeruvus, mis lagundab 5-fluorouratsiili. DPD ekspressiooni, nagu paljude teiste organismis leiduvate ensüümide puhul, reguleerib ööpäevarütm. Seega ei ole 5-FU lagunemine DPD poolt konstantne, vaid varieerub vastavalt kellaajale. Need ööpäevased rütmid võivad infusiooni ajal patsiendi veres 5-FU hulga kümnekordselt varieeruda.
„Kehapinna pindala abil keemiaravi annuse arvutades teame, et kahel inimesel võib 5-fluorouratsiili toksilisus olla väga erinev. Ühel patsiendil võivad olla minimaalse toksilisusega ravitsüklid ja seejärel kohutava toksilisusega tsükkel. Midagi on muutunud selles, kuidas patsient keemiaravi ühest tsüklist teise metaboliseeris. Meie vananenud doseerimismeetod ei kajasta neid muutusi ja patsiendid kannatavad selle tagajärjel,“ ütleb Douglas Rubinson, Dana-Farberi vähiinstituudi kliiniline onkoloog ja artikli autor.
Üks viis keemiaravi farmakokineetika varieeruvuse kompenseerimiseks on strateegia, mida nimetatakse terapeutilise ravimi jälgimiseks, mille puhul patsient annab ühe ravitsükli lõpus vereproovi. Pärast seda, kui see proov on ravimi kontsentratsiooni suhtes analüüsitud, saab annust vajadusel järgmise tsükli alguses (tavaliselt 5-fluorouratsiili puhul kahe nädala pärast) kohandada.
See lähenemisviis on näidanud patsientidele paremaid tulemusi, kuid seda pole laialdaselt kasutatud keemiaravi, näiteks 5-fluorouratsiili puhul.
MIT-i teadlased soovisid välja töötada sarnase jälgimisviisi, kuid automatiseeritud viisil, mis võimaldaks ravimite doseerimist reaalajas isikupärastada, mis võiks patsientidele paremaid tulemusi anda.
Nende suletud ahelaga süsteemis saab ravimikontsentratsioone pidevalt jälgida ja seda teavet kasutatakse keemiaravi ravimi infusioonikiiruse automaatseks reguleerimiseks, et hoida annus sihtvahemikus.
See suletud ahelaga süsteem võimaldab ravimiannust isikupärastada, võttes arvesse ravimeid metaboliseerivate ensüümide taseme ööpäevaseid rütme, samuti kõiki muutusi patsiendi farmakokineetikas pärast viimast ravi, näiteks keemiaravi poolt põhjustatud organtoksilisust.
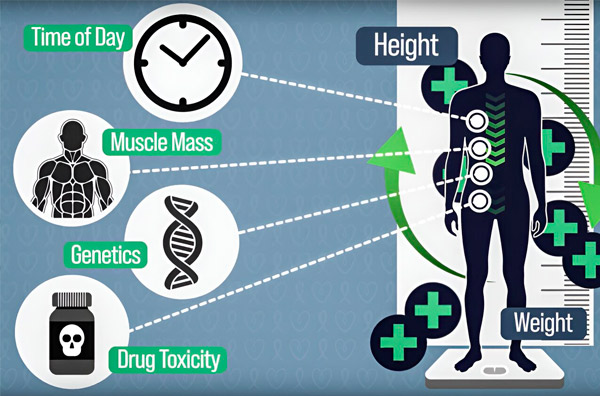
Keemiaravi annustamise täpsemaks muutmiseks on MIT insenerid välja töötanud meetodi, mis võimaldab pidevalt mõõta ravimi hulka patsiendi kehas mitmetunnise infusiooni ajal. See aitab kompenseerida keha koostise, geneetika, ravimitoksilisuse ja ööpäevase rütmi kõikumiste põhjustatud erinevusi. Allikas: Teadlaste nõusolekul.
Teadlaste väljatöötatud uus süsteem, mida tuntakse kui CLAUDIA (Closed-Loop AUtomated Drug Infusion regulAtor), kasutab iga etapi jaoks kaubanduslikult saadaval olevaid seadmeid. Vereproove võetakse iga viie minuti järel ja need valmistatakse kiiresti analüüsiks ette. Mõõdetakse 5-fluorouratsiili kontsentratsiooni veres ja võrreldakse sihtvahemikuga.
Siht- ja mõõdetud kontsentratsioonide erinevus sisestatakse juhtimisalgoritmi, mis seejärel reguleerib infusioonikiirust vastavalt vajadusele, et hoida annust kontsentratsioonide vahemikus, mille juures ravim on efektiivne ja mittetoksiline.
"Oleme välja töötanud süsteemi, kus saame pidevalt mõõta ravimi kontsentratsiooni ja vastavalt reguleerida infusioonikiirust, et säilitada ravimi kontsentratsioon terapeutilises aknas," ütleb DeRidder.
Kiire reguleerimine
Loomkatsetes leidsid teadlased, et CLAUDIA abil suutsid nad hoida kehas ringleva ravimi koguse sihtvahemikus umbes 45 protsenti ajast.
Loomadel, kellele manustati keemiaravi ilma CLAUDIA-ta, püsis ravimi tase sihtvahemikus keskmiselt vaid 13 protsendil ajast. Teadlased ei testinud selles uuringus ravimitasemete efektiivsust, kuid arvatakse, et kontsentratsioonide hoidmine sihtvahemikus annab paremaid tulemusi ja väiksema toksilisuse.
CLAUDIA suutis hoida 5-fluorouratsiili annust sihtvahemikus isegi siis, kui manustati ravimit, mis inhibeerib DPD ensüümi. Loomadel, kellele manustati seda inhibiitorit ilma pideva jälgimise ja annuse kohandamiseta, suurenes 5-fluorouratsiili tase kuni kaheksakordselt.
Selle demonstratsiooni jaoks viisid teadlased iga protsessi etapi käsitsi läbi, kasutades selleks tavalisi seadmeid, kuid nüüd plaanivad nad iga sammu automatiseerida, et jälgimist ja annuse kohandamist saaks teha ilma inimese sekkumiseta.
Ravimite kontsentratsioonide mõõtmiseks kasutasid teadlased kõrgefektiivset vedelikkromatograafiat-massispektromeetriat (HPLC-MS), tehnikat, mida saab kohandada peaaegu igat tüüpi ravimite tuvastamiseks.
„Me näeme tulevikku, kus saame CLAUDIAt kasutada iga ravimi puhul, millel on sobivad farmakokineetilised omadused ja mis on HPLC-MS-i abil tuvastatav, võimaldades paljude erinevate ravimite personaalset annustamist,“ ütleb DeRidder.
