Artikli meditsiiniline ekspert
Uued väljaanded
Aju glioom
Viimati vaadatud: 29.06.2025

Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
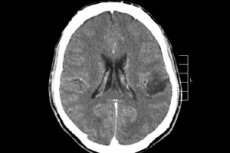
Kesknärvisüsteemi paljude kasvajaliste protsesside hulgas diagnoositakse kõige sagedamini ajukiloom – see termin on kollektiivne, neoplasm ühendab kõik difuussed oligodendrogliaalsed ja astrotsütaarsed kolded, astrotsütoom, astroblastoom jne. Sellisel kasvajal võib olla erinev pahaloomulisuse aste, see moodustub gliaalstruktuuridest – neuronite ümber paiknevatest rakkudest. Glioomide peamised paiknemispiirkonnad on ajupoolkerad, ajuvatsakeste seinad ja kiasm – nägemisnärvikiudude osalise ristumiskoha piirkond. Väliselt on kasvaja roosaka või punaka tooniga sõlmeline element, ümmarguse või spindlikujulise konfiguratsiooniga, millel on ebamäärased piirid. [ 1 ]
Epidemioloogia
Umbes 5% juhtudest on glioomid seotud pärilike patoloogiatega - eelkõige neurofibromatoosi ja teiste domineeriva pärandi sündroomidega. Eksperdid märgivad, et absoluutne enamus aju glioomidest areneb juhuslikult - see tähendab ilma selge põhjuseta.
Kesknärvisüsteemi primaarsed kasvajad moodustavad kokku ligikaudu 2% kõigist kasvajatest ehk veidi üle 21 juhtumi saja tuhande elaniku kohta. Nende hulgas esineb glioome 35–36% juhtudest ja üle 15% neist on glioblastoomid.
Mõnede andmete kohaselt mõjutab glioom mehi sagedamini kui naisi - kasvaja on eriti levinud üle 50-aastaste inimeste seas.
Glioomide esinemissagedus eakate seas on viimastel aastakümnetel märkimisväärselt suurenenud. Selle nähtuse põhjuseid pole veel kindlaks tehtud.
Maailma Terviseorganisatsiooni definitsiooni kohaselt on tuvastatud kolm peamist gliaalkasvajate varianti, mis erinevad oma histoloogiliste omaduste poolest. Need on oligodendroglioomid, astrotsütoomid ja kombineeritud oligoastrotsütoomid. Iga madala pahaloomulisuse astmega patoloogia alatüübi esinemissagedust ei ole usaldusväärselt kindlaks määratud. Mõned uuringud näitavad oligodendroglioomide esinemissageduse suurenemist 5%-lt 30%-le ja astrotsütoomide esinemissageduse vähenemist.
Gliaalkasvajad on võimelised infiltreeruma ajukoesse ja valdav enamus madala astme fookustest pahaloomuliseks muutuvad mõne aasta jooksul. [ 2 ]
Põhjused aju glioomid
Aju glioom on terve rühm kasvajalisi protsesse, mille ühiseks tunnuseks on nende moodustumine ajukoes paiknevatest KNS-i gliaalstruktuuridest. Sellised kasvajad jagunevad kahte histopatoloogiliseks variandiks: kõrge pahaloomulisuse ja madala pahaloomulisuse glioomid.
Kasvu moodustumise allikaks on neuroglia rakud (astrotsüüdid, oligodendrotsüüdid), mis pakuvad aju neuronite struktuurilist alust ja elujõulisust.
Gliaalsed kasvajaprotsessid erinevad oluliselt struktuuri, geenide mutatsiooniliste muutuste, agressiivsuse, kliiniliste tunnuste, diagnostiliste omaduste, ravivastuse ja patsientide prognoosi poolest. Kesknärvisüsteemi embrüonaalsed ja ependümaalsed kasvajad - eriti medulloblastoomid ja ependümoomid - erinevad oma histoloogilise struktuuri poolest, kuid on ravi poolest sarnased.
Gliaalelemendid liigitati esmakordselt närvisüsteemi eraldi struktuurikategooriaks 19. sajandi lõpus.
Neuroglia kude koosneb rakkudest, millel on abifunktsioonid: troofiline, tugi-, kaitse- ja sekretoorne. Neuronid ja gliotsüüdid eksisteerivad koos, moodustavad koos närvisüsteemi ja omavad suurt tähtsust organismi elutegevuse üldprotsessides.
Gliotsüüdid jagunevad laias laastus mitmeks põhitüübiks: astrotsüüdid, oligodendrotsüüdid, ependümaalsed rakud ja mikrogliiad.
Praeguseks ei suuda teadlased vastata küsimusele neurogliaalse kasvaja tekke usaldusväärsete põhjuste kohta. Arvatavasti annavad teatud negatiivse panuse radioaktiivsed mõjud, nakkushaigused, joove (eriti keemiline, tööalane). Samuti on oluline pärilik tegur.
Aju glioomid tekivad ebanormaalsetest neurogliotsüütidest, millel on geneetiline defekt, mis viib ebanormaalse kasvu ja funktsionaalsuseni – selliseid struktuure nimetatakse "ebaküpseteks". Mittetäielikud rakud paiknevad sagedamini ühes piirkonnas, kus moodustub kasvaja.
Lihtsamalt öeldes on gliaalrakkude moodustumine modifitseeritud neuroglia rakkude kaootilise ja juhusliku kasvu tulemus. Protsess võib areneda ependümotsüütidest, oligodendrotsüütidest, astrotsüütidest (astrotsütoom, sealhulgas hiidrakuline ja anaplastiline). [ 3 ]
Riskitegurid
Hoolimata asjaolust, et eksperdid ei suuda gliaalonkopatoloogiate tekke põhjuseid täpselt iseloomustada, saab mõnel juhul nende väljanägemist vältida peamiste riskitegurite kõrvaldamisega:
- Ioniseeriva kiirgusega kokkupuutel on kantserogeenne toime, see võib põhjustada leukeemia arengut ja tiheda struktuuriga vähirakkude teket, sealhulgas noortel inimestel. Sagedased ja ebamõistlikud radioloogilised meditsiinilised protseduurid, ultraviolettkiirgus (sh solaarium) kuuluvad samuti potentsiaalselt kantserogeensete mõjude hulka ning võivad põhjustada kasvajate teket erinevates organites, sealhulgas ajus.
- Tööalased kahjulikud mõjud, mürgistused, on sageli põhjuslikus seoses vähkkasvajate tekkega. Eriti ohtlikuks peetakse kummi ja klaasi, pestitsiidide ja kütuste, metallide ja tekstiilide, värvide ja laborireagentide tootmist. Ohustatud on töötajad lennunduses, söe- ja metallitööstuses, keemia- ja kõrvalsaaduste tootmisettevõtetes, ehitusmaterjalide ja elektroodide, kütuste ja määrdeainete, plastide ja monomeeride tootmisel.
- Õhu-, vee- ja pinnasereostus põhjustab kuni 4% kõigist maailma vähipatoloogiatest. Keskkonnas suurtes kogustes esinevad kantserogeenid satuvad organismi sissehingatava õhu, joogivee ja toiduga. Eriti ohtlikuks peetakse elamist ökoloogiliselt ohtlikes piirkondades – suurte tööstusrajatiste ja tiheda liiklusega transpordisõlmede lähedal.
- Nakkushaigused – eriti viirusnakkused – võivad samuti luua soodsaid tingimusi kasvajate tekkeks. Oluline on seda meeles pidada ja eelnevalt vaktsineerida, samuti nakkus- ja parasiithaiguste ennetamiseks.
- Tubaka- ja alkoholimürgitust peetakse paljude vähivormide, mitte ainult aju glioomide riskiteguriteks.
- Ebapiisav füüsiline aktiivsus, ülekaal, ebatervislik toitumine, ainevahetushäired, peavigastused, veresoonkonna patoloogiad - täiendavad stressifaktorid, mis võivad esile kutsuda rakusiseste häirete algust.
- Vanem iga on kõige levinum periood neoplasmide tekkeks kehas, seega peaksid üle 55-aastased inimesed oma tervise eest eriti hoolitsema.
Glioblastoomi tekke peamine ja olulisim riskitegur on aga pärilik eelsoodumus.
Pathogenesis
Praeguseks on ekspertidel aju glioomide arengu kohta mitmeid oletusi. Igal teoorial on oma alused, kuid ainsat õiget ja usaldusväärset patogeneetilist mehhanismi pole teadlased veel kindlaks teinud. Enamasti räägime kasvajate arengus järgmistest teguritest:
Embrüogeneesi ebaõnnestumine, mis seisneb elundite munemise häirimises ja "valede" rakustruktuuride moodustumises;
- Kokkupuude ioniseerivate kiirtega, potentsiaalsete kantserogeenidega keemiliste ainete, toidulisandite jms kujul;
- Peavigastus;
- Põlvest põlve edasikanduvad geenihäired ("perekondlik" glioom);
- Immuunsüsteemi häired, neuroinfektsioonid.
Enamikul glioomidel on difuusne kasv, mis tungib ümbritsevasse normaalsesse ajukoesse. Sõltuvalt pahaloomulisuse astmest võib kasvaja areneda mitu aastat ilma igasuguste ilminguteta. Agressiivse kulgu korral süveneb sümptomaatika kiiresti mitme kuu jooksul.
Osa kasvaja tekkest on tingitud düsembrüogeneetilistest muutustest.
Ajutüvi võib olla mõjutatud erinevatel tasanditel: difuusne ajutüve glioom omakorda erineb nii anatoomilis-morfoloogiliselt kui ka kliiniliselt. Mõned sellised kasvajad – eriti kvadripleegia plaadi glioom – võivad olla suhteliselt healoomulised, ilma progresseerumise tunnusteta. Silla glioomi seevastu iseloomustab eriline pahaloomulisus, agressiivsus ja halb prognoos.
Aju struktuuride difuussed kahjustused, mille korral patoloogilises protsessis on kaasatud rohkem kui kolm suurte poolkerade anatoomilist tsooni, võimaliku periventrikulaarse lahknemise ja läbimisega korpuskõnest gliomatoos [ 4 ].
Kas aju glioom on pärilik?
Aju glioomi tekke riskiks on hästi tõestatud pärilikkus – see tähendab sarnaste või muude ajusiseste kasvajate esinemist otsestel esivanematel või samas põlvkonnas. Radioaktiivne kiirgus ja regulaarne või pikaajaline kokkupuude potentsiaalsete kantserogeenidega süvendavad olukorda.
Pärilikud võivad olla mitte ainult glioomid, vaid ka haigused, millega kaasneb suurenenud kasvaja kasv olenemata lokaliseerimisest - eelkõige võib see olla 1. ja 2. tüüpi neurofibromatoos, Li-Fraumeni sündroom, Hippel-Lindau. Sageli avastatakse glioomirakkudes muutusi teatud geenides või kromosoomides.
Tabelis on kokku võetud peamised patoloogiad, mis on seotud glioomi tekkega inimestel:
Patoloogia |
Kromosoom |
Geen |
Kasvajate mitmekesisus |
Li-Fraumeni sündroom |
17. märts 13 |
TR53 |
Neuroektodermaalsed kasvajad, astrotsütoom. |
Neurofibromatoos |
17q11 |
NF1 |
Nägemisnärvi glioom, pilotsüütiline astrotsütoom, neurofibromatoos |
Turcotte'i sündroom |
3p21, 7p22 |
HMLH1, HPSM2 |
Astrotsütoom |
Tuberoosne skleroos (Burneville'i sündroom). |
9q34, 16p13 |
TSC1, TSC2 |
Gigantotsellulaarne subependümaalne astrotsütoom |
Olenemata gliaalse kasvaja olemusest, olgu tegemist juhusliku juhtumi või päriliku patoloogiaga, on tegemist häirega, millega kaasneb patoloogiliselt muutunud geeni ekspressioon. Lisaks õppimisefektide tagajärjel tekkinud kasvajatele jäävad geneetiliste muutuste põhjused ka muudes olukordades ebaselgeks.
Sümptomid aju glioomid
Fokaalse sümptomatoloogia tunnused sõltuvad otseselt aju glioomi lokaliseerimise piirkonnast ja muutuvad igasuguste endokriinsete häirete, närvikoe kokkusurumise või kohalike hävitavate protsesside tagajärjeks.
Kui neoplasm asub parietaalses tsoonis, siis domineerivad inimesel sellised ilmingud nagu krambid, sensoorsed häired, kuulmislangus.
Kui glioom lokaliseerub domineeriva poolkera piirkonnas, tuvastatakse kõnehäired, agraafia, agnosia.
Oimusagara neoplasmadega kaasnevad sageli krambid, afaasia, lõhna- ja nägemisfunktsiooni häired ning õhupuudus.
Kui koljusisene rõhk suureneb, tekib vastav pilt koos nägemisväljade piiramise, silmalihaste halvatuse ja hemipleegiaga.
Kasvajaprotsessi spetsiifilisuse tõttu kaasnevad aju glioomiga alati suuremal või vähemal määral neuroloogilised sümptomid. Alguses on märgatav üldine nõrkus, patsient tahab pidevalt magada, töövõime on häiritud, mõtteprotsessid on aeglustunud. Just selles etapis on suur oht panna vale diagnoos ja selle tagajärjel määrata vale ravi. Muude mittespetsiifiliste ilmingute hulgas on:
- Vestibulaarsed häired, sh ebakindel kõnnak, tasakaalu kaotus (nt jalgrattasõidul või trepist ronimisel), jäsemete tuimus jne;
- Nägemise järkjärguline halvenemine, visuaalse pildi kahekordistumine;
- Kuulmisfunktsiooni halvenemine;
- Ebaselge kõne;
- Iiveldus ja oksendamine rünnakute kujul, mis ei sõltu toidust ega joogist;
- Miimiliste lihaste ja teiste näolihaste nõrgenemine;
- Ebamugavustunne neelamisel;
- Regulaarsed peavalud (sageli hommikuti).
Kliiniline pilt laieneb ja süveneb järk-järgult: mõnel patsiendil juhtub see aeglaselt, teistel - järsult, sõna otseses mõttes "nende silme all", mõne nädala jooksul. Viimasel juhul räägime agressiivsest, kiiresti arenevast aju glioomist.
Esimesed märgid
Aju glioomil arengu algstaadiumis ei ole väljendunud sümptomeid. Esimesed ilmingud aetakse sageli ekslikult teiste, vähem ohtlike patoloogiate tunnustega.
Üldiselt on glioomi kliiniline pilt mitmekesine ja selle määrab patoloogilise fookuse asukoht ja suurus. Kasvaja kasvades tekivad ja süvenevad üldised aju sümptomid:
- Püsiv ja regulaarne peavalu, mis ei reageeri tavapärastele ravimitele (mittesteroidsed põletikuvastased ravimid);
- Vahelduv iiveldus, mõnikord kuni oksendamiseni;
- Ebamugav, raskustunne silmamuna piirkonnas;
- Krambid.
Tserebraalsed ilmingud on eriti intensiivsed, kui kasvaja kasvab vatsakestesse või liköörisüsteemi. Tserebrospinaalvedeliku äravool on häiritud, koljusisene rõhk suureneb ja tekib hüdrotsefaalia. Protsess mõjutab teatud ajuosa, mis omakorda mõjutab vastava kliiniku arengut:
- Nägemisfunktsiooniga on probleeme;
- Kõnehäire;
- Esinevad vestibulaarsed häired (pearinglus, liigutuste koordinatsiooni häired);
- Parees, käte, jalgade halvatus;
- Mälu ja keskendumisvõime on häiritud;
- Mõtteprotsessid on häiritud;
- Käitumishäired hakkavad tekkima.
Esialgses staadiumis sümptomid praktiliselt puuduvad või on need nii tähtsusetud, et ei ärata tähelepanu. Sel põhjusel soovitavad eksperdid tungivalt regulaarseid ennetavaid uuringuid ja tervisekontrolle. Lõppude lõpuks, mida varem kasvajaprotsess avastatakse, seda suuremad on ravi ja ellujäämise võimalused. [ 5 ]
Aju glioom lapsel
Paljude lapsepõlves avastatud ajukasvajate hulgas on glioomide osakaal 15–25%. Lapsed võivad haigestuda varases teismeeas ja kahekümnendate alguses, kuigi alla 3-aastastel imikutel on see väga haruldane.
Patoloogia algab gliaalrakkude mutatsiooni taustal. Praeguseks pole vastust küsimusele, miks see mutatsioon tekib.
Ainus, mida on usaldusväärselt teada saadud, on see, et teatud pärilikud haigused, mis on seotud kasvaja kasvu suurenenud riskiga, suurendavad ka ajukilooma tekke tõenäosust.
Lisaks on teadlased avastanud, et gliaalrakkudel võib esineda lahknevusi üksikutes geenides või kromosoomides. Selle häire tõttu käivitub mutatsioonimehhanism, mis ei ole pärilik. On võimalik, et see toimub ühes varasemas arengujärgus.
On tõestatud fakt, et ägeda leukeemia või retinoblastoomi esinemine lapse anamneesis või aju kiiritus mis tahes muul põhjusel suurendab oluliselt glioomi tekke riski (teatud aja möödudes).
Lapsepõlves esinev sümptomatoloogia sõltub pahaloomulisuse astmest ja patoloogilise fookuse lokaliseerimisest. Eristatakse spetsiifilisi ja mittespetsiifilisi sümptomeid:
- Mittespetsiifilised sümptomid ei ole seotud glioomi asukohaga. Levinumad ilmingud võivad olla peavalu, pearinglus, isutus, oksendamine ilma toiduga seostamata, kaalulangus (teadmata põhjustel), pidev väsimustunne, õpitulemuste langus, keskendumisraskused, käitumishäired. Need nähud tulenevad koljusistes olevate struktuuride kokkusurumisest, mida saab seletada kasvava massi otsese survega, ja tserebrospinaalvedeliku ringluse häirega. Esineb aju hüdrokeeli oht.
- Spetsiifiline sümptomatoloogia sõltub gliaalse patoloogilise fookuse vahetust asukohast. Näiteks väikeaju kasvajaga kaasneb lastel tavaliselt kõnnaku ja tasakaalu häire. Suure aju kahjustus avaldub krampidena ja kasvaja kasv seljaajus - lihaskonna halvatusena. Juhtub, et lapse nägemine halveneb järsult, teadvus on häiritud, uni on häiritud või tekib mõni muu arenguprobleem.
Reeglina avaldub pahaloomuline glioom lapsepõlves mõne nädala või kuu jooksul pärast selle arengut: seda iseloomustab sageli neoplasmi kiire ja kontrollimatu kasv.
Pahaloomuliste gliaalkasvajatega lapsi ravivad laste onkoloogiale spetsialiseerunud laste kliiniliste keskuste arstid. Reeglina kasutatakse kirurgilist ravi, kiiritusravi ja keemiaravi kuure.
Kõige olulisem ravietapp on neurokirurgia. Mida radikaalsem see on, seda paremad on lapse võimalused tervenemiseks. Kuid kirurgiline sekkumine pole alati võimalik: eriti võivad probleemid tekkida ajutüve glioomide eemaldamisel, samuti alla 3-aastaste laste kiiritusravi korral.
Keskaju glioomid (vahepealne ja keskmine ajuosa) on raske täielikult eemaldada, kuna on oht kahjustada terveid kudesid. Kui kasvaja täielik eemaldamine on võimatu, määratakse patsiendile palliatiivne ravi.
Pahaloomuliste glioomidega lapsi ravitakse standardiseeritud protokollide kohaselt, mis on kindlaks määratud rangelt kontrollitud kliiniliste uuringute käigus. Kõige levinumad protokollid on järgmised:
- HIT HGG 2007: hõlmab 3–17-aastaste laste ravi.
- HIT SKK: sobib imikutele (kuni kolmeaastased) ja ei hõlma kiiritusravi.
Glioomade laste elulemuse statistika ei ole üldiselt väga optimistlik. Siiski ei ole mingil juhul võimalik ette ennustada ravimeetmete efektiivsust konkreetse lapse puhul. Oluline on hoolikalt järgida kõiki arsti ettekirjutusi, mis suurendab oluliselt taastumise võimalusi.
Vormid
Glioom võib olla madala ja kõrge pahaloomulisusega, intensiivse kasvu ja metastaaside tekke kalduvusega. Oluline on mõista, et madal pahaloomulisus ei ole sünonüüm kasvaja ohutusele. Iga ajukasvaja loob lisamahtu, pigistab ajustruktuure, mis viib nende nihkumiseni ja koljusisese rõhu suurenemiseni. Selle tagajärjel võib patsient surra.
Pahaloomulisi astrotsütoome on kahte peamist tüüpi. Need on glioblastoomid ja anaplastilised astrotsütoomid, mis jagunevad molekulaarsete muutuste järgi. Astrotsütoomidest arenenud sekundaarsed pahaloomulised kasvajad, millel on madal pahaloomulisuse aste, esinevad kõige sagedamini noortel patsientidel. Algselt pahaloomulised gliaaltüüpi kasvajad esinevad sagedamini eakatel patsientidel.
Sõltuvalt struktuuri asukohast jagunevad glioomid järgmistesse tüüpidesse:
- Supratentoriaalne (lokaliseerumisega väikeaju kohal külgmiste vatsakeste, suurte poolkerade piirkonnas);
- Subtentoriaalne (lokaliseerumisega väikeaju all tagumises koljuõõnes).
Histoloogiliste tunnuste järgi eristatakse selliseid glioomide tüüpe:
- Astrotsütaarne glioom on kõige levinum. See omakorda jaguneb sõlmeliseks ja difuusseks (viimast iseloomustab kiire kasv ja insuldi muster).
- Oligodendroglioom – esineb 5%-l patsientidest. Sellel on kivistunud moodustised – kaltsifikatsioonipiirkonnad, kõige sagedamini otsmikusagaras.
- Ependümaalne glioom - kasvab seljaaju ja vatsakeste tsentraalse kanali seinu vooderdavatest struktuuridest. Kasvab sageli nii ajuaine paksusesse kui ka aju valendikku.
Võimalikud on ka segapatoloogilised fookused, näiteks subependümoom, oligoastrotsütoom jne.
Kõik glioomid jagunevad järgmistesse etappidesse:
- Aeglaselt kasvavad suhteliselt healoomulised kasvajad ilma ilmsete kliiniliste sümptomiteta.
- Aeglaselt kasvavad "piiripealsed" glioomid, mis järk-järgult muutuvad III staadiumiks ja kaugemale.
- Pahaloomuline glioom.
- Pahaloomuline glioom intensiivse agressiivse kasvu ja levikuga, halva prognoosiga.
Mida madalam on pahaloomulisuse staadium, seda väiksem on eemaldatud kasvaja metastaaside ja kordumise tõenäosus ning seda suuremad on patsiendi tervenemisvõimalused. Suurimat ohtu kujutab multiformne glioblastoom, mis on intensiivse kasvu ja arenguga vähediferentseeritud protsess. [ 6 ]
Neuroglioomi võimalikud ja levinumad variandid:
- Ajutüve ja silla kahjustustega glioom asub piirkonnas, kus aju ühendub seljaajuga. Just seal paiknevad olulised neurokeskused, mis vastutavad hingamis-, südame- ja motoorsete funktsioonide eest. Kui see tsoon on kahjustatud, on häiritud vestibulaar- ja kõneaparaadi töö. Seda avastatakse sageli lapsepõlves.
- Nägemisglioom mõjutab nägemisnärvi ümbritsevaid neurogliiarakke. Patoloogia põhjustab nägemiskahjustusi ja eksoftalmust. See tekib sagedamini lastel.
- Madala pahaloomulise neuroglioomi iseloomustab aeglane kasv, mis lokaliseerub sagedamini suurtes ajupoolkerades ja väikeajus. See esineb sagedamini noortel inimestel (noorukitel ja umbes 20-aastastel noortel täiskasvanutel).
- Corpus callosumi glioom on iseloomulikum 40–60-aastastele inimestele ja seda esindab kõige sagedamini glioblastoom.
- Kiasma glioom lokaliseerub nägemisnärvi ühenduskohas, seega kaasneb sellega lühinägelikkus, nägemisvälja kadu, oklusiivne hüdrotsefaalia ja neuroendokriinsed häired. See võib esineda igas vanuses, kuid kõige sagedamini mõjutab see I tüüpi neurofibromatoosiga patsiente.
Tüsistused ja tagajärjed
Madala pahaloomulisuse astmega glioomid (I-II aste, väga pahaloomulised - nt astrotsütoom, oligoastrotsütoom, oligodendroglioom, pleomorfne ksantoastrotsütoom jne) ja kõrge pahaloomulisuse astmega glioomid (III-IV aste - glioblastoom, anaplastiline oligodendroglioom, oligoastrotsütoom ja astrotsütoom). IV astme glioomid on eriti pahaloomulised.
Ajutüve glioomil on väga ebasoodne prognoos just seetõttu, et neoplasm mõjutab sellist ajupiirkonda, kus on koondunud kõige olulisemad närviühendused aju ja jäsemete vahel. Isegi üsna väike kasvaja selles piirkonnas on piisav, et patsiendi seisund kiiresti halveneks ja provotseeriks halvatust.
Mitte vähem ebasoodsad tagajärjed tekivad ka siis, kui mõjutatud on ka teised ajupiirkonnad. Sageli on tegemist ajukoore kasvajaga, mis ei anna patsiendile ravist hoolimata võimalust pikaks elueaks. Sageli on võimalik ainult surma edasi lükata.
Meditsiinilise statistika kohaselt on viieaastane elulemus sageli vaid 10-20%. Kuigi need arvud sõltuvad suuresti nii pahaloomulisuse astmest kui ka teostatud kirurgilise sekkumise täpsest lokaliseerimisest ja mahust. Pärast patoloogilise fookuse täielikku eemaldamist suureneb elulemus märkimisväärselt (mõnikord - kuni 50%). Ravi puudumine või selle võimatus (ühel või teisel põhjusel) viib garanteeritult patsiendi surmani.
Enamik madala pahaloomulise gliaaltuumoreid on võimelised infiltreeruma ajukoesse ja pahaloomuliseks muutuma mitme aasta jooksul.
Gliooma kordumise ohtu peavad eksperdid "väga tõenäoliseks". Sellest hoolimata ei tohiks ravi unarusse jätta: oluline on tagada hea elukvaliteet nii kaua kui võimalik.
Korduvatel glioomidel on alati halvem prognoos kui primaarsetel kasvajatel. Siiski saavutavad terapeutilise optimeerimise uuringutel põhinevad kaasaegsed raviprotokollid sageli piisavalt häid tulemusi isegi väga pahaloomuliste kasvajate korral.
Võimalikud tagajärjed pärast keemiaravi:
- Kõhenemine, kõhnumine, seedehäired, suuhaigused;
- Kesknärvisüsteemi suurenenud erutuvus, asteenia;
- Kuulmisfunktsiooni halvenemine, tinnitus ja tinnitus;
- Krambid, depressiivsed häired;
- Hüpertensiivne kriis, vere koostise muutus;
- Neerupuudulikkus;
- Allergilised protsessid, juuste väljalangemine, pigmendilaikude ilmumine kehale.
Pärast keemiaravi täheldavad patsiendid immuunsüsteemi märgatavat nõrgenemist, mis võib põhjustada erinevate nakkushaiguste teket.
Diagnostika aju glioomid
Aju glioomi võib kahtlustada järgmiste sümptomite ilmnemisel:
- Patsiendil esinevad lokaalsed või generaliseerunud krambid, mis on iseloomulikud neoplasmi kortikaalsele paiknemisele ja selle aeglasele arengule. Epikrampe esineb 80%-l madala astme gliaalse kasvajaga patsientidest ja 30%-l kõrge astme glioomiga patsientidest.
- Suurenenud koljusisene rõhk on eriti iseloomulik paremas otsmikusagaras ja parietaalsagaras paiknevatele moodustistele. Kõrge koljusisene rõhuga seotud vereringe- ja likvoreringe häirega kaasnevad pidev ja süvenev peavalu, iiveldus koos oksendamisega, nägemishäired, unisus. Esineb nägemisnärvi turse ja suunava närvi halvatus. Koljusisene rõhu tõus kriitiliste väärtusteni võib viia kooma ja surma tekkeni. Teine kõrge silmasisese rõhu põhjus on hüdrotsefaalia.
- Patsiendil on kasvav fokaalne pilt. Supratentoriaalsete formatsioonide korral on häiritud motoorne ja sensoorne sfäär, progresseeruvad hemioopia, afaasia ja kognitiivsed häired.
Kui arst kahtlustab ajukasvaja esinemist, on optimaalne teha MRI ilma kontrastaine (gadoliiniumi) manustamiseta või ilma, et välja selgitada selle asukoht, suurus ja täiendavad omadused. Kui magnetresonantstomograafia pole võimalik, tehakse kompuutertomograafia ja diferentseerimismeetodina kasutatakse magnetresonantsspektroskoopiat. Vaatamata nende diagnostiliste meetodite informatiivsusele pannakse lõplik diagnoos alles pärast histoloogilist kinnitust kasvaja fookuse resektsiooni käigus.
Eeltoodud kriteeriumide põhjal on soovitatav diagnoosi alustada põhjaliku anamneesi, somatoneuroloogilise ja funktsionaalse seisundi hindamisega. Neuroloogilist seisundit hinnatakse koos tõenäoliste intellektuaalsete ja mäluhäirete kindlakstegemisega.
Soovitatavad laboritestid:
- Täielik üldine kliiniline vereanalüüs;
- Täielik vere keemiline paneel;
- Uriinianalüüs;
- Vere hüübimise uuring;
- Onkoloogiliste markerite analüüs (AFP, beeta-hCG, LDH - oluline, kui kahtlustatakse käbikeha tsooni kahjustust).
Glioblastoomi ja anaplastilise astrotsütoomiga patsientide prognostiliste punktide selgitamiseks hinnatakse IDH1|2-1 geeni mutatsiooni ja MGMT geeni metülatsiooni. Oligodendroglioomi ja oligoastrotsütoomiga patsientidel määratakse 1p|19q kodellatsioon.
Instrumentaalne diagnostika hõlmab eelkõige aju (mõnikord ka seljaaju) kohustuslikku magnetresonantstomograafiat. MRI tehakse kolmes projektsioonis, kasutades kontrastainega standardseid T1-2, FLAIR, T1 režiime.
Näidustuste korral tehakse veresoonte võrgustiku ultraheli, motoorsete ja kõneosade funktsionaalne magnetresonantstomograafia, samuti angiograafia, spektroskoopia, MR-traktograafia ja perfusioon.
Täiendavad uuringud võivad hõlmata järgmist:
- Aju elektroentsefalograafia;
- Konsultatsioonid neurokirurgi, onkoloogi, radioloogi, oftalmoloogi, radioloogiga.
Diferentseeritud diagnoos
Diferentsiaaldiagnoos viiakse läbi tingimata mittekasvajaliste patoloogiate korral - eriti arteriovenoosse või arteriaalse väärarengu põhjustatud hemorraagia, samuti pseudotumoraalsete demüeliniseerivate protsesside, põletikuliste haiguste (toksoplasmoos, ajuabstsess jne) korral.
Lisaks eristage primaarset kasvaja fookust ja kesknärvisüsteemi metastaase.
Tänapäevaste magnetresonantstomograafia võimalustega on võimalik teha diagnostilisi meetmeid piisavalt täpselt, et välja selgitada primaarse fookuse päritolu KNS-is. Aju MRI-uuringut tehakse kontrastainega või ilma, T1, T2 FLAIR-režiimis - kolmes projektsioonis või õhukeste viiludena aksiaalprojektsioonis (SPGR-režiim). Need diagnostilised meetodid võimaldavad täpselt määrata neoplasmi asukohta, suurust, struktuurilisi omadusi, selle seost veresoonte võrgustiku ja lähedalasuvate ajupiirkondadega.
Lisaks võib diferentsiaaldiagnoosi osana teha kompuutertomograafiat (kontrastainega või ilma), kompuutertomograafia angiograafiat (MR angiograafia), MR traktograafiat, MR või KT perfusiooni. Näidustuse korral kasutatakse aju kompuutertomograafiat/PET-uuringut metioniini, koliini, türosiini ja teiste aminohapetega.
Ravi aju glioomid
Spetsiifiline ravi koosneb kirurgilistest, keemiaravi ja kiiritusravi meetmetest. Võimaluse korral on kohustuslik läbi viia kasvaja fookuse täielik resektsioon, mis võimaldab kiiret sümptomite leevendamist ja diagnoosi histoloogilist kinnitamist.
Kiiritusravi mõjutab positiivselt patsientide eluiga. Standardina manustatakse kogudoosi 58–60 Gy, mis jagatakse individuaalseteks 1,8–2 Gy kiiritusdoosideks. Kasvajat kiiritatakse lokaalselt, lisaks haarates kuni 3 cm kiirgust selle ümbert. Kiiritusravi on vastuvõetavam kui brahhüteraapia. Mõnel juhul on soovitatav radiosurgilised meetodid, mis hõlmavad kiiritamist gamma-noaga või lineaarse gaasipedaaliga, samuti neutronipüüdmise boorravi.
Adjuvantse keemiaravi vajadus on vastuoluline. Mõnel juhul võimaldasid nitrosourea preparaadid pikendada patsientide eluiga kuni poolteist aastat, kuid mõned selliste keemiaravi preparaatide kasutamise tulemused olid negatiivsed. Tänapäeval kasutatakse aktiivselt tsütotoksilisi aineid, neoadjuvantset ravi (enne kiiritusravi), kombineeritud ravimeid, intraarteriaalset keemiaravi või suurtes annustes keemiaravi koos edasise tüvirakkude siirdamisega.
Üldiselt on glioomide edukaks raviks väga oluline terviklik lähenemine, mille ulatus sõltub massi asukohast ja pahaloomulisuse astmest, selle suurusest ning patsiendi üldisest tervislikust seisundist.
Ajutüve glioomi puhul kasutatakse kirurgilist sekkumist harva. Operatsiooni peamine vastunäidustus on kolde lokaliseerimine – elutähtsate osade vahetus läheduses. Mõnel juhul on tüve glioomi võimalik eemaldada mikrokirurgiliste meetoditega, preoperatiivse ja postoperatiivse keemiaraviga. Selline sekkumine on väga keeruline ja nõuab neurokirurgi erikvalifikatsiooni.
Kiiritusravi ja eriti stereotaktiline kirurgia, mille käigus tehakse kokkupuudet suurte ioniseerivate doosidega, on üsna tõhusad. Sellise tehnika kasutamine neoplasmi arengu varases staadiumis võimaldab mõnikord saavutada pikaajalise remissiooni või isegi patsiendi täieliku tervenemise.
Kiiritusravi kombineeritakse sageli keemiaraviga, mis parandab sekkumiste efektiivsust ja vähendab kiirituskoormust. Glioomide puhul ei ole kõik keemiaravi ennetavad ained terapeutiliselt edukad, seega määratakse need individuaalselt ja vajadusel kohandatakse retsepte.
Valu vähendamiseks ja koljusisese rõhu alandamiseks, olenemata peamisest ravist, on ette nähtud sümptomaatiline ravi - eelkõige kortikosteroidravimid, valuvaigistid, rahustid.
Ravimid
Kortikosteroidravimid mõjutavad turset, vähendavad neuroloogiliste sümptomite raskust mitmeks päevaks. Siiski kasutatakse mitmete kõrvaltoimete ja keemiaravi ravimitega koostoimete suurenenud tõenäosuse tõttu steroide minimaalselt efektiivsetes annustes, lõpetades nende manustamise nii kiiresti kui võimalik (nt pärast operatsiooni).
Krambivastaseid aineid kasutatakse süstemaatiliselt sekundaarse ennetusmeetmena patsientidel, kellel on juba epilepsiahooge esinenud. Need ravimid võivad põhjustada tõsiseid kõrvaltoimeid ja suhelda ka keemiaravi ravimitega.
Antikoagulandid on eriti olulised postoperatiivses staadiumis, kuna tromboflebiidi tekke risk glioomi korral on üsna kõrge (kuni 25%).
Hea efekti on oodata antidepressantide-anksiolüütikumide võtmisest. Metüülfenidaadi kasutamine annuses 10-30 mg/päevas kahes annuses võimaldab sageli optimeerida kognitiivseid võimeid, parandada elukvaliteeti ja säilitada töövõimet.
Neuroloogiline rike ja ajuödeemi tunnused (peavalu, teadvusehäired) kõrvaldatakse kortikosteroidravimite - eriti prednisolooni või deksametasooni - abil. |
Kortikosteroidide skeem ja annus valitakse individuaalselt, järgides minimaalset efektiivset annust. Ravikuuri lõpus tühistatakse ravimid järk-järgult. |
Kortikosteroide võetakse koos gastroprotektiivsete ravimitega - prootonpumba blokaatorite või H2-histamiini blokaatoritega. |
Diureetikumid (furosemiid, mannitool) on ette nähtud aju struktuuride tugeva turse ja nihke korral, lisaks kortikosteroidravimitele. |
Konvulsiivsete krampide (sh anamneesis) või elektroentsefalogrammil epileptiformsete sümptomite korral määratakse lisaks krambivastane ravi. Krambivastaseid ravimeid ei määrata profülaktilistel eesmärkidel. |
Keemiaravi näidustustel patsientidel on soovitatav võtta krambivastaseid ravimeid, mis ei mõjuta maksaensüümide funktsiooni. Valitud ravimid: lamotrigiin, valproehape, levetiratsetaam. Ei tohiks kasutada: karbamasepiini, fenobarbitaali. |
Aju glioomide peavalu ravitakse kortikosteroidraviga. |
Mõnel peavalu korral võib kasutada mittesteroidseid põletikuvastaseid ravimeid või tramadooli. |
Kui patsient võtab mittesteroidseid põletikuvastaseid ravimeid, lõpetatakse nende võtmine paar päeva enne operatsiooni, et minimeerida verejooksu võimalust operatsiooni ajal. |
Teatud valujuhtudel võib soovitada narkootilisi valuvaigisteid – näiteks fentanüüli või trimeperidiini. |
Kopsuemboolia vältimiseks alates kolmandast postoperatiivsest päevast on ette nähtud madala molekulmassiga hepariinide - eriti naatriumenoksapariini või kaltsiumi nadropariini - manustamine. |
Kui patsient saab süstemaatilist antikoagulant- või trombotsüütidevastast ravi, viiakse ta hiljemalt nädal enne kirurgilist sekkumist üle madalmolekulaarsetele hepariinidele, kusjuures nende edasine ärajätmine toimub päev enne operatsiooni ja jätkamine 24–48 tundi pärast operatsiooni. |
Kui glioomiga patsiendil on alajäsemete venoosne tromboos, viiakse läbi ravi otseste antikoagulantidega. CAVA-filtri paigaldamise võimalust ei välistata. |
Aju pahaloomuliste glioomide keemiaravi
Glioomide põhilised kasvajavastase keemiaravi režiimid on järgmised:
- Lomustiin 100 mg/m² esimesel päeval, vinkristiin 1,5 mg/m² esimesel ja kaheksandal päeval, prokarbasiin 70 mg/m² kaheksandast kuni kahekümne esimese päevani, kuurid iga kuue nädala järel.
- Lomustiin 110 mg/m² iga kuue nädala järel.
- Temosolomiid 5/23 150 kuni 200 mg/m² esimesest päevast kuni viienda päevani iga 28 päeva järel.
- Temosolomiid osana keemia-kiiritusravist, 75 mg/m² iga päev, mil kiiritust manustatakse.
- Temosolomiidi koos tsisplatiini või karboplatiiniga (80 mg/m²) ja Temosolomiidi 150–200 mg/m² 1. kuni 5. päeval iga 4 nädala järel.
- Temosolomiidi 7/7 annuses 100 mg/m² ravikuuri 1.-8. ja 15.-22. päeval, korrates iga nelja nädala järel.
- Bevatsizumab 5–10 mg/kg esimesel ja viieteistkümnendal päeval ning irinotekaan 200 mg/m² esimesel ja viieteistkümnendal päeval, korrates iga nelja nädala järel.
- Bevatsizumab 5–10 mg/kg esimesel, viieteistkümnendal ja kahekümne üheksandal päeval ning lomustiin 90 mg/m² esimesel päeval iga kuue nädala järel.
- Bevatsizumab 5–10 mg/kg esimesel ja viieteistkümnendal päeval, lomustiin 40 mg esimesel, kaheksandal, viieteistkümnendal ja kahekümne teisel päeval, korrates iga kuue nädala järel.
- Bevatsizumab 5–10 mg/kg esimesel ja viieteistkümnendal päeval, korrates seda iga nelja nädala järel.
Tsütostaatikumid pärsivad paljudel juhtudel edukalt kasvajarakkude kasvu, kuid ei näita selektiivsust tervete kudede ja organite suhtes. Seetõttu on eksperdid tuvastanud mitmeid vastunäidustusi, mille korral glioomi keemiaravi on võimatu:
- Liigne individuaalne tundlikkus kemopreventiivsete ainete suhtes;
- Südame-, neeru- ja maksafunktsiooni dekompensatsioon;
- Depressiooniga vereloome luuüdis;
- Neerupealiste funktsiooni probleemid.
Keemiaravi manustatakse äärmise ettevaatusega:
- Patsiendid, kellel on märkimisväärsed südame rütmihäired;
- Diabeediga;
- Ägedate viirusnakkuste korral;
- Eakatele patsientidele;
- Kroonilise alkoholismi (kroonilise alkoholimürgistuse) all kannatavad patsiendid.
Kemopreventiivsete ravimite kõige tõsisem kõrvaltoime on nende toksilisus: tsütostaatikumid mõjutavad selektiivselt vererakkude funktsionaalsust ja muudavad nende koostist. Selle tagajärjel väheneb trombotsüütide ja erütrotsüütide mass ning tekib aneemia.
Enne patsiendile keemiaravi kuuri määramist võtab arst alati arvesse ravimite toksilisuse astet ja tõenäolisi tüsistusi pärast nende kasutamist. Keemiaravi kuure jälgivad alati hoolikalt spetsialistid ja regulaarselt vereanalüüsid.
Tsütostaatilise ravi võimalikud tagajärjed:
- Kõhnus, kõhnumine;
- Toidu neelamisraskused, kuivad limaskestad, periodontiit, düspepsia;
- Kesknärvisüsteemi ebastabiilsus, maniakaal-depressiivsed häired, krambihoogude sündroom, asteenia;
- Kuulmisfunktsiooni halvenemine;
- Vererõhu tõus kuni hüpertensiivse kriisi tekkeni;
- Trombotsüütide, punaste vereliblede, valgete vereliblede arvu vähenemine, mitmed hemorraagiad, sisemine ja väline verejooks;
- Neerupuudulikkus;
- Allergilised protsessid;
- Juuste väljalangemine, suurenenud pigmentatsiooniga piirkondade ilmumine.
Pärast keemiaravi kuure on patsientidel suurenenud risk nakkushaiguste tekkeks ning lihas- ja liigesevalu on sage.
Kemoterapeutiliste kõrvaltoimete riski vähendamiseks on tingimata ette nähtud täiendavad rehabilitatsioonimeetmed, mille eesmärk on taastada normaalne vereanalüüs, stabiliseerida kardiovaskulaarne aktiivsus, normaliseerida neuroloogilist seisundit. Vajadusel osutatakse piisavat psühholoogilist tuge.
Kirurgiline ravi
Operatsioon viiakse läbi kasvaja fookuse võimalikult suureks eemaldamiseks, mis omakorda peaks vähendama koljusisene rõhk, vähendama neuroloogilist puudulikkust ja andma vajaliku biomaterjali uuringuteks.
- Operatsioon viiakse läbi spetsialiseeritud neurokirurgia osakonnas või kliinikus, mille spetsialistidel on kogemusi neuroonkoloogiliste sekkumistega.
- Kirurg teostab juurdepääsu kahtlustatava glioomi lokaliseerimise piirkonnas plastilise luu trepanatsiooni abil.
- Kui neoplasm paikneb anatoomiliselt motoorsete piirkondade või radade lähedal või tuumades või kraniaalnärvide ääres, kasutatakse intraoperatiivset neurofüsioloogilist jälgimist.
- Neoplasma eemaldamise maksimeerimiseks on soovitav kasutada neuronavigatsioonisüsteeme ja intraoperatiivset fluorestsentsnavigatsiooni 5-aminolevuleenhappega.
- Pärast sekkumist tehakse 1.-2. päeval kontroll-KT või MRT (kontrastaine süstimisega või ilma).
Kui glioomi kirurgiline eemaldamine on võimatu või esialgu tunnistatud ebaotstarbekaks või kui kahtlustatakse kesknärvisüsteemi lümfoomi, tehakse biopsia (avatud, stereotaktiline, navigatsioonimonitooringuga jne). |
Aju gliomatoosiga patsiente kontrollitakse stereotaktilise biopsia abil, kuna terapeutilised taktikad sõltuvad suuresti histoloogilisest pildist. |
Teatud olukordades - eakatel patsientidel, raskete neuroloogiliste häirete korral, glioomi lokaliseerumisel tüves ja teistes elutähtsates osades - planeeritakse ravi sümptomite ja pildiuuringute teabe põhjal pärast üldist meditsiinilist konsultatsiooni. |
Piloidse astrotsütoomiga patsientidel, samuti ajutüve neoplasmade sõlmeliste vormide ja eksofüütiliste protsessidega patsientidel on soovitatav läbi viia resektsioon või avatud biopsia. |
Hajusa pontiini glioomi ja teiste kere difuussete kasvajatega patsiente ravitakse kiiritusravi ja kasvajavastase ravimiga. Sellistel juhtudel ei ole verifitseerimine vajalik. |
Pärast aju hüdrokeeli eemaldamist tehakse kvadripleegilise plaadiglioomiga patsientidele süstemaatiline magnetresonantstomograafia ja kliiniline jälgimine. Kui kasvaja näitab kasvu märke, eemaldatakse see edasise kiiritusega. |
Madala astme pahaloomulise glioomi osalise resektsiooni või biopsia teostamisel ravitakse kahe või enama riskiteguriga patsiente tingimata kiiritusravi ja/või keemiaraviga. |
Subependümaalse hiidrakulise astrotsütoomiga patsientidele on täielik resektsioon kohustuslik. |
Everoliimust määratakse difuusse subependümaalse hiiglasliku rakulise astrotsütoomi korral. |
Piloidne astrotsütoom tuleks pärast sekkumist magnetresonantstomograafia abil eemaldada, et selgitada kasvajakoe radikaalse resektsiooni kvaliteeti. |
Glioblastoomi korral tuleb postoperatiivset ravi (kiiritusravi + keemiaravi) kombineerida temosolomiidi manustamisega. |
Anaplastilise astrotsütoomi korral pärast operatsiooni on näidustatud kiiritusravi koos edasise ravimteraapiaga. Kasutatakse lomustiini, temosolomiidi. |
Anaplastilise oligodendroglioomi või oligoastrotsütoomiga patsiendid saavad pärast operatsiooni nii kiiritusravi kui ka keemiaravi (temosolomiidi või PCV monoteraapia). |
Eakatele patsientidele, kellel on ulatuslik kõrge pahaloomulisuse aste, manustatakse hüpofraktsioneeritud kiiritusravi või manustatakse Temosolomiidi monoteraapiat. |
Gliomia kordumise korral arutab spetsialistide konsiilium kordusoperatsiooni võimalust ja järgnevat ravitaktikat. Optimaalne raviskeem korduste korral: kordusoperatsioon + süsteemne keemiaravi + korduv kiiritusravi + palliatiivsed meetmed. Kui esineb lokaliseeritud väiksemaid korduva kasvaja kasvu alasid, võib kasutada radiokirurgiat. |
Korduva glioomi kasvu korral valitud ravimid on temosolomid ja bevatsizumab. |
Temosolomiidi ravi näidustuseks on väga pahaloomuliste oligodendroglioomide ja anaplastiliste astrotsütoomide kordumine. |
Pleomorfne ksantoastrotsütoom eemaldatakse ilma kohustusliku adjuvantse keemiaravita. |
Glioomide üks iseärasusi on nende ravi ja eemaldamise raskus. Kirurgi eesmärk on eemaldada kasvaja kuded võimalikult täielikult, et saavutada seisundi kompenseerimine. Paljud patsiendid suudavad parandada elukvaliteeti ja pikendada seda, kuid väga pahaloomuliste kasvajate puhul jääb prognoos ebasoodsaks: suureneb patoloogilise fookuse taaskasvu tõenäosus.
Toitumine aju glioomi korral
Pahaloomuliste kasvajatega patsientide toitumine – oluline punkt, millele kahjuks paljud inimesed ei pööra erilist tähelepanu. Samal ajal on tänu toitumise muutustele võimalik glioomi arengut aeglustada ning tugevdada ja nõrgestada immuunsust.
Peamised toitumisharjumuste muutmise valdkonnad:
- Ainevahetusprotsesside normaliseerimine, immuunsüsteemi tugevdamine;
- Keha detoksifitseerimine;
- Energiapotentsiaali optimeerimine;
- Kõigi keha organite ja süsteemide normaalse toimimise tagamine neile nii raskel perioodil.
Ratsionaalne ja tasakaalustatud toitumine on vajalik nii pahaloomuliste kasvajate algstaadiumis kui ka glioblastoomi viimases staadiumis patsientidel. Hoolikalt valitud toitumine aitab kaasa üldise heaolu paranemisele ja kahjustatud kudede taastumisele, mis on eriti oluline tsütostaatiliste ja kiiritusravi taustal. Toitumiskomponentide tasakaal ja õiged ainevahetusprotsessid takistavad nakkuskollete teket, blokeerivad põletikulisi reaktsioone ja ennetavad organismi kurnatust.
Aju glioomi korral on soovitatavad järgmised toidud ja joogid:
- Punased, kollased ja oranžid puu- ja köögiviljad (tomatid, virsikud, aprikoosid, porgandid, peedid, tsitrusviljad), mis sisaldavad karotenoide, mis kaitsevad terveid rakke kiiritusravi negatiivsete mõjude eest;
- Kapsas (lillkapsas, brokkoli, rooskapsas), redis, sinep ja muud taimsed saadused, mis sisaldavad indooli - toimeainet, mis neutraliseerib kahjulikke toksilisi ja keemilisi tegureid;
- Rohelised (till, petersell, noored võilille- ja nõgeselehed, rabarber, rukola, spinat), rohelised herned ja spargel, spargli oad ja vetikad (merevetikad, spirulina, klorella);
- Roheline tee;
- Küüslauk, sibul, ananass, millel on kasvajavastane ja võõrutusvõime;
- Kliid, teraviljad, täisteraleib, kaunviljade, teraviljade ja seemnete idandatud idud;
- Tumedad viinamarjad, vaarikad, maasikad ja maasikad, mustikad, murakad, granaatõun, sõstrad, mustad sõstrad, pihlakad, mustikad, astelpaju, kirsid ja muud marjad, mis sisaldavad looduslikke antioksüdante, mis vähendavad vabade radikaalide, viiruste ja kantserogeenide negatiivset mõju;
- Madala rasvasisaldusega piimatooted.
Seedesüsteemi ja kogu keha ei tohiks koormata raskete ja rasvaste toitudega. Kasulik on kasutada värskelt pressitud omatehtud mahlu, smuutisid, suupisteid. Roogadele tuleks lisada oomega-3-rasvhapete allikaid, näiteks kalaõli, linaseemneõli või linaseemneid.
Suhkrut ja maiustusi on parem täielikult vältida. Kuid lusikatäis mett tassi veega ei tee paha: mesindussaadustel on tugev põletikuvastane, antioksüdantne ja kasvajavastane toime. Mee kasutamise ainus vastunäidustus on allergia toote suhtes.
Dieedist tuleks välja jätta:
- Liha, seapekk, rups;
- Või, rasvased piimatooted;
- Suitsuliha, vorstid, liha- ja kalakonservid;
- Alkohol mis tahes kujul;
- Maiustused, saiakesed, koogid ja kondiitritooted, kommid ja šokolaadid;
- Kiirtoit, suupisted, mugavustoidud;
- Praetud toidud.
Iga päev tuleks tarbida piisavalt köögivilju, rohelisi, puuvilju ja puhast joogivett.
Keemiaravi ajal ja mõnda aega pärast seda tuleks juua omatehtud köögivilja- ja puuviljamahlu, süüa omatehtud madala rasvasisaldusega kodujuustu, piima ja juustu. Oluline on juua palju vedelikku, pesta hambaid ja loputada suud sageli (umbes 4 korda päevas).
Optimaalsed toidukorrad ajukibuloomiga patsientidele:
- Köögiviljavormiroad;
- Teraviljast (eelistatavalt tatar, kaerahelbed, riis, kuskus, bulgur) valmistatud lisandid ja supid;
- Aurutatud juustukoogid, pudingid, vormiroad;
- Hautatud ja küpsetatud köögiviljad;
- Hautised, köögiviljasupid, kaunviljadest (sh sojast) valmistatud esimesed ja teised road, pasteedid ja sufleed;
- Smuutid, roheline tee, kompotid ja palad.
Ärahoidmine
Kui inimene elab tervislikku eluviisi ja tema sugulaste seas pole vähipatoloogia juhtumeid olnud, on tal kõik võimalused mitte saada ajukibleoomi. Selliste kasvajate spetsiifilist ennetamist ei ole, seega peetakse peamisteks ennetuspunktideks õiget toitumist, füüsilist aktiivsust, halbade harjumuste vältimist ning töö- ja olmeriskide puudumist.
Spetsialistid annavad mitmeid lihtsaid, kuid tõhusaid soovitusi:
- Joo rohkem puhast vett, väldi magustatud limonaadi, pakendatud mahla, energiajooke ja alkoholi.
- Vältige tööalaseid ja olmeprobleeme: vähem kokkupuudet kemikaalide, söövitavate lahuste ja vedelikega.
- Proovige toitu valmistada keetmise, hautamise, küpsetamise, aga mitte praadimise teel. Eelistage tervislikke ja kvaliteetseid omatehtud toite.
- Suur osa teie toidust peaks olema taimne toit, sealhulgas rohelised, olenemata aastaajast.
- Teine negatiivne tegur on ülekaal, millest tuleks lahti saada. Kaalukontroll on kogu keha tervise jaoks väga oluline.
- Taimseid õlisid tuleks alati eelistada võile ja seapekile.
- Võimalusel on soovitav eelistada keskkonnasõbralikke tooteid, hormoonideta liha, nitraatide ja pestitsiidideta köögivilju ja puuvilju. Parem on punast liha täielikult vältida.
- Ärge võtke multivitamiinipreparaate ilma näidustusteta ja suurtes kogustes. Ärge võtke mingeid ravimeid ilma arsti retseptita: iseravimine on sageli väga-väga ohtlik.
- Kahtlaste sümptomite ilmnemisel on vaja külastada arsti, ootamata olukorra süvenemist, kõrvaltoimete ja tüsistuste teket.
- Maiustused ja kõrge glükeemilise indeksiga toidud on dieedi ebasoovitav komponent.
- Mida varem inimene arstide juurde pöördub, seda paremad on tema ravivõimalused (ja see kehtib peaaegu iga haiguse, sealhulgas aju glioomi kohta).
Onkopatoloogia tekke vältimiseks on vaja piisavalt aega magamiseks ja puhkamiseks, vältida alkohoolsete jookide liigset tarbimist, eelistada kvaliteetset looduslikku toitu ja vähendada vidinate (eriti mobiiltelefonide) kasutamist.
Kasvajahaigused esinevad sageli eakatel ja eakatel inimestel. Seetõttu on oluline jälgida oma tervist juba noorelt ja mitte provotseerida patoloogilisi protsesse ebatervisliku eluviisi ja halbade harjumustega.
Onkoloogia täpseid algpõhjuseid pole veel selgitatud. Teatud rolli mängivad aga muidugi ebasoodsad töö- ja keskkonnatingimused, kokkupuude ioniseeriva ja elektromagnetilise kiirgusega ning hormonaalsed muutused. Ärge viibige pikka aega ja regulaarselt päikese käes, ärge laske ümbritseva õhu temperatuuril järske muutusi, ärge ülekuumenege vannis või saunas, ärge võtke sageli kuuma vanni või dušši.
Veel üks küsimus: kuidas vältida ajukibuloomi kordumist pärast selle edukat ravi? Kasvaja taastekkimine on keeruline ja kahjuks sagedane tüsistus, mida on raske ette ennustada. Patsientidele võib soovitada regulaarseid ennetavaid uuringuid ja tervisekontrolle, vähemalt kaks korda aastas onkoloogi ja raviarsti külastamist, tervislikku eluviisi, tervisliku ja loodusliku toidu söömist ning mõõdukat füüsilist aktiivsust. Teine tingimus on elurõõm, terve optimism, positiivne suhtumine edusse igas olukorras. See hõlmab ka sõbralikku õhkkonda perekonnas ja tööl, kannatlikkust ja lähedaste tingimusteta tuge.
Prognoos
Aju seisund ja glioomi omadused selle avastamise ajal mõjutavad elulemust sama palju kui manustatud ravi. Patsiendi rahuldav üldine tervislik seisund ja vanus parandavad prognoosi (noortel patsientidel on prognoos optimistlikum). Oluline näitaja on kasvaja histoloogiline pilt. Seega on madala astme glioomidel parem prognoos kui anaplastilistel glioomidel ja veelgi enam glioblastoomidel (kõige ebasoodsamad kasvajaprotsessid). Astrotsütoomidel on halvem prognoos kui oligodendroglioomidel.
Pahaloomulised astrotsütoomid alluvad ravile halvasti ja nende elulemus on suhteliselt madal, kuus kuni viis aastat. Samal ajal on madala astme glioomide eeldatav eluiga hinnanguliselt 1–10 aastat.
Pahaloomulised astrotsütoomid on sisuliselt ravimatud. Ravi suund hõlmab tavaliselt neuroloogiliste ilmingute (sh kognitiivse düsfunktsiooni) vähendamist ja eluea pikendamist, säilitades samal ajal võimalikult kõrge elukvaliteedi. Sümptomaatiline ravi on suunatud rehabilitatsioonimeetmete taustale. Samuti on oluline psühholoogi töö.
Viimase kümnendi jooksul on teadlased teinud teatavaid edusamme ajukasvajate olemuse ja ravimeetodite mõistmisel. Haiguse prognoosi optimeerimiseks tuleks palju rohkem ära teha. Spetsialistide peamine ülesanne on tänapäeval järgmine: ajukasvaja puhul peaks olema mitu skeemi probleemi tõhusaks kõrvaldamiseks korraga, nii varajases kui ka hilisemas arengujärgus.

