Artikli meditsiiniline ekspert
Uued väljaanded
B-hepatiidi patogenees
Viimati vaadatud: 07.07.2025

Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
B-hepatiidi patogeneesis on patogeneetilises ahelas mitu juhtivat lüli:
- patogeeni sissetoomine - infektsioon;
- fikseerimine hepatotsüüdil ja tungimine rakku;
- viiruse paljunemine ja selle "väljasurumine" hepatotsüütide pinnale, samuti verre;
- immunoloogiliste reaktsioonide aktiveerimine, mille eesmärk on patogeeni kõrvaldamine;
- immuunkompleksi kahjustus organitele ja süsteemidele;
- immuunsuse teke, patogeenist vabanemine, taastumine.
Kuna B-hepatiidi infektsioon toimub alati parenteraalselt, võib eeldada, et nakatumise hetk on praktiliselt samaväärne viiruse tungimisega verre. Mõnede teadlaste katsed eristada B-hepatiidi enteraalset ja regionaalset faasi on vähe põhjendatud. On rohkem alust arvata, et viirus siseneb kohe maksa koos vereringega.
B-hepatiidi viiruse tropismi maksakoe suhtes määrab HBsAg-s spetsiaalse retseptori olemasolu - polüpeptiid molekulmassiga 31 000 Da (P31), millel on albumiiniga seondumise aktiivsus. Sarnane albumiini tsoon leidub ka inimese ja šimpansi maksa hepatotsüütide membraanil, mis määrab oluliselt HBV tropismi inimese ja šimpansi maksa suhtes.
Kui viirus tungib hepatotsüüti, vabaneb viiruse DNA, mis sisenedes hepatotsüüdi tuuma ja toimides nukleiinhapete sünteesi maatriksina, käivitab rea järjestikuseid bioloogilisi reaktsioone, mille tulemuseks on viiruse nukleokapsiidi kokkupanek. Nukleokapsiid migreerub läbi tuumamembraani tsütoplasmasse, kus toimub Dane'i osakeste - täieliku B-hepatiidi viiruse - lõplik kokkupanek.
Siiski tuleb märkida, et hepatotsüüdi nakatumisel võib protsess toimuda kahel viisil - replikatiivselt ja integreerivalt. Esimesel juhul tekib ägeda või kroonilise hepatiidi pilt ja teisel - viiruse kandlus.
Põhjuseid, mis määravad viirusliku DNA ja hepatotsüütide vahelise kahe interaktsiooni tüübi, pole täpselt kindlaks tehtud. Tõenäoliselt on vastuse tüüp geneetiliselt määratud.
Replikatiivse interaktsiooni tulemuseks on põhiliste antigeenistruktuuride (tuumas) ja tervikliku viiruse (tsütoplasmas) kokkupanek, millele järgneb tervikliku viiruse või selle antigeenide esitlemine membraanil või hepatotsüütide membraani struktuuris.
Üldiselt on aktsepteeritud, et viiruse replikatsioon ei põhjusta hepatotsüütide tasemel rakkude kahjustusi, kuna B-hepatiidi viirusel puudub tsütopaatiline toime. Seda seisukohta ei saa pidada vaieldamatuks, kuna see põhineb eksperimentaalsetel andmetel, mis küll viitavad B-hepatiidi viiruse tsütopaatilise toime puudumisele, kuid saadi koekultuuridelt ja seetõttu ei saa neid täielikult ekstrapoleerida viirushepatiidile B inimestel. Igal juhul vajab hepatotsüütide kahjustuse puudumise küsimus replikatsioonifaasis täiendavaid uuringuid.
Kuid olenemata viiruse ja raku interaktsiooni iseloomust, osaleb maks tingimata immunopatoloogilisse protsessi. Sellisel juhul on hepatotsüütide kahjustus seotud asjaoluga, et viirusantigeenide ekspressiooni tagajärjel hepatotsüütide membraanil ja viirusantigeenide vabanemisel vabasse vereringesse toimub järjestikuste rakuliste ja humoraalsete immuunreaktsioonide ahel, mille lõppeesmärk on viiruse eemaldamine organismist. See protsess viiakse läbi täielikus kooskõlas viirusnakkuste immuunvastuse üldiste mustritega. Patogeeni elimineerimiseks kaasatakse rakulised tsütotoksilised reaktsioonid, mida vahendavad erinevad efektorrakkude klassid: K-rakud, T-rakud, looduslikud tapjarakud, makrofaagid. Nende reaktsioonide käigus hävitatakse nakatunud hepatotsüüdid, millega kaasneb viirusantigeenide (HBcAg, HBeAg, HBsAg) vabanemine, mis käivitavad antikehade tekkesüsteemi, mille tulemusel veres kogunevad spetsiifilised antikehad, peamiselt tuuma suhtes - anti-HBc ja e-antigeen - anti-HBE. Järelikult toimub maksarakkude vabanemine viirusest selle surma protsessis rakulise tsütolüüsi reaktsioonide tõttu.
Samal ajal seonduvad veres akumuleeruvad spetsiifilised antikehad viiruse antigeenidega, moodustades makrofaagide poolt fagotsüteeritud ja neerude kaudu eritatud immuunkomplekse. Sellisel juhul võivad esineda mitmesugused immuunkomplekside kahjustused glomerulonefriidi, arteriidi, artralgia, nahalööbe jms kujul. Spetsiifiliste antikehade osalusel puhastatakse organism patogeenist ja toimub täielik taastumine.
Kooskõlas B-hepatiidi patogeneesi välja toodud kontseptsiooniga seletatakse haiguse kulgu kliiniliste variantide mitmekesisust tavaliselt viiruse interaktsiooni ja immunokompetentsete rakkude koostöö iseärasustega, teisisõnu immuunvastuse tugevusega viirusantigeenide olemasolu suhtes. Kaasaegsete kontseptsioonide kohaselt on immuunvastuse tugevus geneetiliselt määratud ja seotud esimese klassi HLA lookuse histosobivusantigeenidega.
Üldiselt on aktsepteeritud, et viiruse antigeenidele piisava immuunvastuse tingimustes areneb äge hepatiit kliiniliselt tsüklilise kulgemise ja täieliku paranemisega. Viiruse antigeenidele immuunvastuse vähenemise taustal ekspresseerub immuunvahendatud tsütolüüs ebaoluliselt, mistõttu nakatunud maksarakkude efektiivne eliminatsioon puudub, mis viib kergete kliiniliste ilminguteni koos viiruse pikaajalise püsimisega ja võimalusel kroonilise hepatiidi tekkega. Samal ajal, vastupidi, geneetiliselt määratud tugeva immuunvastuse ja massiivse infektsiooni (hemotransfusiooni) korral tekivad ulatuslikud maksarakkude kahjustuse alad, mis kliiniliselt vastavad haiguse rasketele ja pahaloomulistele vormidele.
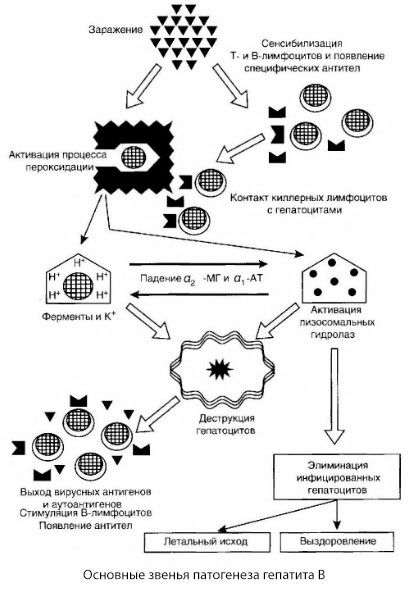
Esitatud B-hepatiidi patogeneesi skeemi iseloomustab selle sidusus, kuid see sisaldab mitmeid vastuolulisi ja vähe uuritud punkte.
Kui lähtuda B-hepatiidi kui immunopatoloogilise haiguse kontseptsioonist, võib eeldada rakulise tsütotoksilisuse reaktsioonide sagenemist haiguse raskusastme suurenedes. Raskete vormide korral on aga rakulise immuunsuse seose näitajad järsult langenud, sealhulgas mitmekordselt võrreldes tervete lastega, ja K-rakkude tsütotoksilisuse indeks. Pahaloomulise vormi korral, massiivse maksanekroosi ja eriti maksakooma tekkeperioodil, on lümfotsüütidel täielik võimetus fütohemattlutiniini, stafülokoki endotoksiini ja HBsAg mõjul blasttransformatsiooniks. Lisaks puudub leukotsüütidel võime migreeruda vastavalt leukotsüütide migratsiooni inhibeerimisreaktsioonile (LMIC) ning fluorestsentse tetratsükliini sondiga tehtud uuringute tulemuste kohaselt on lümfotsüütide membraanide läbilaskvuse järsk suurenemine.
Seega, kui tervetel inimestel on lümfotsüütide fluorestsentsi indeksid 9,9±2% ja tüüpilise healoomulise kuluga B-hepatiidi korral suurenevad need 22,3±2,7%-ni, siis pahaloomuliste vormide korral ulatub fluorestsentsi lümfotsüütide arv keskmiselt 63,5±5,8%-ni. Kuna kirjanduses hinnatakse üheselt rakumembraanide läbilaskvuse suurenemist usaldusväärse näitajana nende funktsionaalse alaväärsuse kohta, võib järeldada, et B-hepatiidi, eriti pahaloomulise vormi korral on lümfotsüütidel ulatuslik kahjustus. Seda tõendavad ka K-rakkude tsütotoksilisuse indeksid. Raske vormi korral on tsütotoksilisus haiguse 1.-2. nädalal 15,5±8,8% ja pahaloomulise vormi korral 1. nädalal 6,0±2,6, 2. nädalal 22,0±6,3%, normiga 44,8±2,6%.
Esitatud andmed näitavad selgelt B-hepatiidi raskete vormidega patsientidel immuunsuse rakulise seose väljendunud häireid. Samuti on ilmne, et need muutused tekivad sekundaarselt, immuunkompetentsete rakkude kahjustuse tagajärjel toksiliste metaboliitide ja võimalusel ka ringlevate immuunkomplekside poolt.
Nagu uuringud on näidanud, väheneb raske B-hepatiidi vormiga patsientidel, eriti massiivse maksanekroosi korral, HBsAg ja HBeAg tiiter vereseerumis ning samal ajal hakatakse tuvastama kõrge tiitriga antikehi pinnaantigeeni vastu, mis on haiguse healoomuliste vormide puhul täiesti ebatüüpiline, mille puhul anti-HBV ilmneb alles haiguse 3.-5. kuul.
B-hepatiidi viiruse antigeenide kiire kadumine koos viirusevastaste antikehade kõrge tiitriga samaaegse ilmnemisega viitab immuunkomplekside intensiivsele moodustumisele ja nende võimalikule osalemisele massiivse maksanekroosi tekke patogeneesis.
Seega ei võimalda faktilised materjalid meil B-hepatiiti üheselt tõlgendada ainult immunopatoloogilise agressiivsuse seisukohast. Ja asi pole ainult selles, et ei leita seost ühelt poolt maksa morfoloogiliste muutuste sügavuse ja levimuse ning teiselt poolt rakulise immuunsuse tegurite raskusastme vahel. Teoreetiliselt võiks seda asjaolu seletada rakulise immuunsuse näitajate uurimise hilisemate etappidega, kui immunokompetentsed rakud allutati maksa suureneva funktsionaalse puudulikkuse tõttu võimsale toksilisele toimele. Muidugi võib eeldada, et hepatotsüütide immuunne tsütolüüs toimub nakkusprotsessi kõige varasemas staadiumis, võib-olla isegi enne raske maksakahjustuse kliiniliste sümptomite ilmnemist. Selline eeldus on aga ebatõenäoline, kuna sarnaseid rakulise immuunsuse näitajaid tuvastati ka haiguse kõige ägedama (välk) kulgemisega patsientidel ja lisaks ei tuvastatud maksakoe morfoloogilisel uurimisel massiivset lümfotsüütide infiltratsiooni, samal ajal kui tuvastati pidevad nekrootilise epiteeli väljad ilma resorptsiooni ja lümfotsüütide agressiooni nähtusteta.
Ägeda hepatiidi morfoloogilist pilti on väga raske seletada ainult immuunrakkude tsütolüüsi seisukohast, seetõttu ei välistatud varastes uuringutes B-hepatiidi viiruse tsütotoksilist toimet.
Praegu on seda oletust osaliselt kinnitanud B-hepatiidi viiruse avastamine. Nagu uuringud on näidanud, sõltub D-hepatiidi markerite tuvastamise sagedus otseselt haiguse raskusastmest: kergete vormide korral avastatakse neid 14%, mõõdukate 18%, raskete 30% ja pahaloomuliste 52% patsientidest. Arvestades, et D-hepatiidi viirusel on nekrootiline tsütopaatiline toime, võib pidada kindlaks tehtud, et B- ja D-hepatiidi viirustega kaasnev infektsioon on B-hepatiidi fulminantsete vormide tekkes väga oluline.
B-hepatiidi patogeneesi saab kirjeldada järgmiselt. Pärast B-hepatiidi viiruse tungimist hepatotsüütidesse kutsuvad nakatunud hepatotsüütidele esile immunoloogilise rünnaku T-tapjad, mis eritavad lümfotoksiinid maksarakkude suunas.
B-hepatiidi hepatotsüütide kahjustuse intiimseid mehhanisme pole veel kindlaks tehtud. Juhtivat rolli mängivad lipiidide peroksüdatsiooni ja lüsosomaalsete hüdrolaaside aktiveeritud protsessid. Päästikuks võivad olla lümfotoksiinid, mis vabanevad efektorrakkudest kokkupuutel hepatotsüütidega, kuid on võimalik, et peroksüdatsiooniprotsesside initsiaatoriks võib olla viirus ise. Seejärel areneb patoloogiline protsess tõenäoliselt järgmises järjestuses.
- Agressiivse faktori (lümfotoksiinide või viiruse) interaktsioon bioloogiliste makromolekulidega (võimalik, et endoplasmaatilise retiikulumi membraanide komponentidega, mis on võimelised osalema detoksifitseerimisprotsessides, analoogselt teiste kahjustavate ainetega, nagu on näidatud süsiniktetrakloriidi puhul).
- Vabade radikaalide moodustumine, lipiidide peroksüdatsiooniprotsesside aktiveerimine ja kõigi hepatotsellulaarsete membraanide läbilaskvuse suurenemine (tsütolüüsi sündroom).
- Bioloogiliselt aktiivsete ainete liikumine mööda kontsentratsioonigradienti - erinevate rakusiseste lokalisatsioonide ensüümide, energiadoonorite, kaaliumi jne kadu. Naatriumi ja kaltsiumi kogunemine rakkudesse, pH nihkumine rakusisese atsidoosi suunas.
- Lüsosomaalsete hüdrolaaside (RNAse, DNAse, katepsiinide jne) aktiveerimine ja vabanemine koos maksarakkude lagunemise ja autoantigeenide vabanemisega.
- T- ja B-immuunsüsteemi stimuleerimine koos T-lümfotsüütide spetsiifilise sensibiliseerimisega maksa lipoproteiinidele, samuti antihepaatiliste humoraalsete autoantikehade moodustumisega.
B-hepatiidi patogeneesi kavandatud skeemis on käivitavaks teguriks viirusantigeenid, mille intensiivset tootmist täheldatakse haiguse varases staadiumis ja kogu ägeda perioodi vältel, välja arvatud pahaloomulised vormid, mille puhul viirusantigeenide tootmine praktiliselt lakkab massilise maksanekroosi tekkimise ajal, mis määrab viiruse replikatsiooni kiire vähenemise.
Samuti on ilmne, et viirusantigeenid aktiveerivad immuunsuse T- ja B-süsteeme. Selle protsessi käigus toimub T-lümfotsüütide alampopulatsioonide iseloomulik ümberjaotumine, mille eesmärk on korraldada piisav immuunvastus, elimineerida nakatunud hepatotsüüte, neutraliseerida viirusantigeene, tekitada sanogeneesi ja taastuda.
Kui immunokompetentsed rakud interakteeruvad viirusantigeenidega hepatotsüütide membraanidel või viiruse paljunemise ajal hepatotsüütides, tekivad tingimused lipiidide peroksüdatsiooniprotsesside aktiveerimiseks, mis, nagu teada, kontrollib kõigi rakuliste ja subtsellulaarsete membraanide läbilaskvust.
Sellest seisukohast saab arusaadavaks tsütolüüsi sündroomi esinemine, mis on viirushepatiidile nii loomulik ja iseloomulik rakumembraanide suurenenud läbilaskvus.
Tsütolüüsi sündroomi lõpptulemuseks võib olla oksüdatiivse fosforüülimise täielik lahtisidumine, rakulise materjali leke ja maksa parenhüümi surm.
Kuid enamikul juhtudel ei saavuta need protsessid nii surmavat arengut. Ainult haiguse pahaloomuliste vormide korral kulgeb patoloogiline protsess laviinitaoliselt ja pöördumatult, kuna tekivad massiline infektsioon, väljendunud immuunprotsess, peroksüdatsiooniprotsesside ja lüsosomaalsete hüdrodaaside liigne aktiveerimine ning autoimmuunse agressiooni nähtused.
Samad mehhanismid on täheldatud ka B-hepatiidi soodsas kulges, ainsa eripäraga, et need kõik realiseeruvad kvalitatiivselt erineval tasemel. Erinevalt massiivse maksanekroosi juhtudest on haiguse soodsas kulges nakatunud hepatotsüütide arv ja seega ka immunopatoloogilise tsütolüüsi tsoon väiksem, lipiidide peroksüdatsiooni protsessid ei ole nii oluliselt suurenenud, happeliste hüdrolaaside aktiveerimine viib vaid piiratud autolüüsini, mille puhul autoantigeenide vabanemine on ebaoluline, ja seetõttu ilma massiivse autoagressioonita, st kõik patogeneesi etapid soodsas kulges viiakse läbi maksa parenhüümi säilinud struktuurilise organisatsiooni raames ja neid piiravad kaitsesüsteemid (antioksüdandid, inhibiitorid jne) ning seetõttu ei ole neil nii hävitavat mõju.
Viirushepatiidi joobesümptomite põhjuseid ei ole täielikult uuritud. Ettepanekut eristada nn primaarset ehk viiruslikku joobestust sekundaarsest (vahetus- ehk metaboolsest) joobesusest võib pidada positiivseks, kuigi see ei paljasta üldise toksilise sündroomi tekke intiimset mehhanismi. Esiteks ei ole hepatiidiviirustel toksilisi omadusi ja teiseks ei ole paljude metaboliitide kontsentratsioon alati korrelatsioonis haiguse raskusastme ja toksikoosi sümptomite avaldumisastmega. Samuti on teada, et viirusantigeenide kontsentratsioon ei ole rangelt korrelatsioonis joobesoleku raskusastmega. Vastupidi, haiguse raskusastme ja seega ka toksikoosi astme suurenemisega HBsAg kontsentratsioon väheneb ja on madalaim pahaloomuliste vormide korral sügava maksakooma tekkimise ajal. Samal ajal sõltuvad spetsiifiliste viirusevastaste antikehade tuvastamise sagedus ja tiitrid otseselt haiguse raskusastmest.
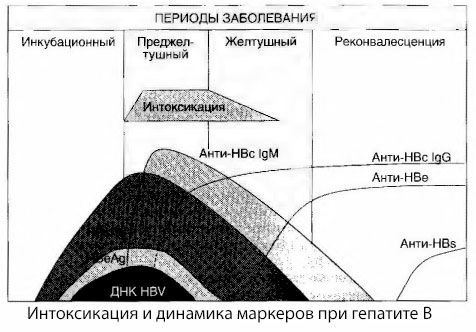
Mürgistus ei ilmne viirusantigeenide registreerimise hetkel, vaid lehma antigeeni ja E-süsteemi antigeeni IgM-klassi viirusevastaste antikehade vereringluse perioodil. Lisaks on raskete ja eriti pahaloomuliste vormide korral märkimisväärsel osal patsientidest veres isegi anti-HB-sid, mida tavaliselt kerge ja mõõduka haiguse vormi korral kunagi ei täheldata.
Esitatud andmed võimaldavad järeldada, et viirushepatiidi ja eriti B-hepatiidi toksikoosi sündroom ei teki viirusantigeenide ilmnemise tagajärjel veres, vaid on viirusantigeenide ja IgM-klassi viirusevastaste antikehade interaktsiooni tagajärg. Sellise interaktsiooni tulemuseks on teadaolevalt immuunkomplekside ja võimalik, et ka aktiivsete toksiliste ainete moodustumine.
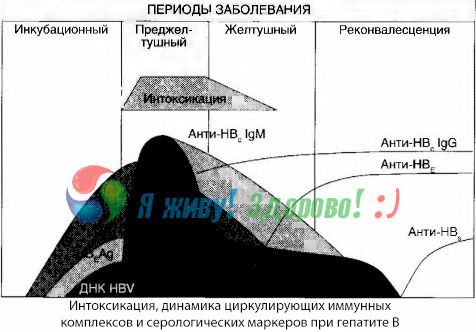
Mürgistuse sümptomid tekivad immuunkomplekside ilmumise hetkel vabas vereringes, kuid hiljem sellist korrelatsiooni ei täheldata.
Osalise seletuse sellele võib leida immuunkomplekside koostise uurimisest. Raskete vormidega patsientidel ringlevad veres valdavalt keskmise suurusega kompleksid, mille koostises domineerivad toksilise sündroomi haripunktis selle klassi antikehad, samas kui kliiniliste ilmingute languse ja paranemise perioodil kompleksid muutuvad suuremaks ja nende koostises hakkavad domineerima IgG klassi antikehad.
Esitatud andmed puudutavad toksilise sündroomi tekkemehhanisme haiguse algperioodil, kuid kliiniliste ilmingute haripunktis esineva toksikoosi korral on neil vaid osaline tähtsus ja eriti maksakooma tekkes.
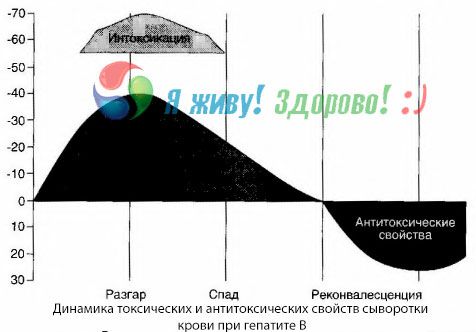
Verekultuuride meetod on näidanud, et B-hepatiidi korral kogunevad veres pidevalt toksiinid, mis vabanevad kahjustatud, lagunevast maksakoest. Nende toksiinide kontsentratsioon on proportsionaalne haiguse raskusastmega ja on valgulise iseloomuga.
Taastumisperioodil ilmuvad veres selle toksiini antikehad; kuid maksakooma korral suureneb toksiini kontsentratsioon veres järsult ja antikehi veres ei tuvastata.
B-hepatiidi patomorfoloogia
Morfoloogiliste muutuste olemuse põhjal eristatakse kolme ägeda B-hepatiidi vormi:
- tsükliline vorm,
- massiline maksanekroos;
- kolestaatiline perikolangiolüütiline hepatiit.
B-hepatiidi tsüklilise vormi korral on düstroofsed, põletikulised ja proliferatiivsed muutused lobulite keskel rohkem väljendunud, samas kui A-hepatiidi korral lokaliseeruvad need lobuli perifeerias, levides keskele. Neid erinevusi seletatakse viiruse erinevate penetratsiooniteedega maksa parenhüümi. A-hepatiidi viirus siseneb maksa portaalveeni kaudu ja levib lobulite keskele, B-hepatiidi viirus tungib läbi maksaarteri ja kapillaaride harude, mis varustavad ühtlaselt kõiki lobuleid, kuni nende keskpunktini.
Maksa parenhüümi kahjustuse aste vastab enamasti haiguse kliiniliste ilmingute raskusastmele. Kergete vormide korral täheldatakse tavaliselt hepatotsüütide fokaalset nekroosi ning mõõduka ja raske vormi korral tsoonilist nekroosi (kalduvus haiguse rasketes vormides ühineda ja moodustada sillakujulist nekroosi).
Parenhüümi suurimad morfoloogilised muutused täheldatakse kliiniliste ilmingute haripunktis, mis tavaliselt langeb kokku haiguse esimese kümnendiga. Teisel ja eriti kolmandal kümnendil intensiivistuvad regeneratsiooniprotsessid. Selleks perioodiks kaovad nekrobiootilised muutused peaaegu täielikult ja domineerima hakkavad rakkude infiltratsiooniprotsessid, millele järgneb hepatotsellulaarsete plaatide struktuuri aeglane taastumine. Maksa parenhüümi struktuuri ja funktsiooni täielik taastumine toimub aga alles 3-6 kuud pärast haiguse algust ja mitte kõigil patsientidel.
B-hepatiidi nakkuse üldistatud olemust kinnitab HBsAg tuvastamine mitte ainult hepatotsüütides, vaid ka neerudes, kopsudes, põrnas, kõhunäärmes, luuüdi rakkudes jne.
Kolestaatiline (perikolangiolüütiline) hepatiit on haiguse erivorm, mille puhul suurimad morfoloogilised muutused esinevad intrahepaatilistes sapijuhades, millega kaasneb kolangioliidi ja perikolangioliidi pilt. Kolestaatilise vormi korral tekib kolestaas sapi kapillaaride laienemisega ja sapi staasiga neis, kolangioolide ja nende ümber olevate rakuliste infiltraatide vohamisega. Maksarakud on selle hepatiidi vormi korral mõjutatud vähe. Kliiniliselt iseloomustab haigust pikaajaline kulg koos pikaajalise kollatõvega. On näidatud, et sellise omapärase haiguse kulgu põhjuseks on viiruse domineeriv mõju kolangioolide seintele, millel on ebaoluline mõju hepatotsüütidele.

