Artikli meditsiiniline ekspert
Uued väljaanded
Harilik raseduse katkemine - põhjused
Viimati vaadatud: 04.07.2025

Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
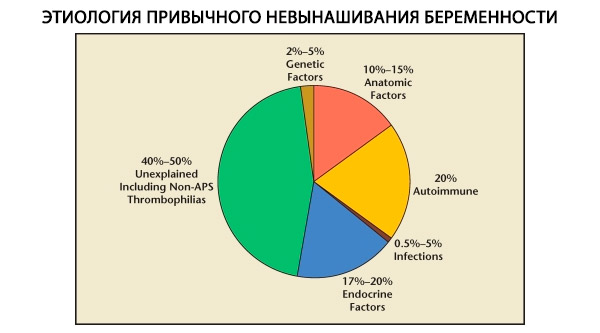
Harjumuspäraste raseduse katkemiste struktuuris eristuvad geneetilised, anatoomilised, endokriinsed, immunoloogilised ja nakkuslikud tegurid. Kui kõik ülaltoodud põhjused on välistatud, jääb alles patsientide rühm, kellel harjumuspärase raseduse katkemise päritolu on ebaselge (idiopaatilised raseduse katkemised). C. Coulami jt (1996) andmetel põhineb 80% idiopaatilistest raseduse katkemistest diagnoosimata immuunsüsteemi häiretel.
Puuduvad veenvad tõendid selle kohta, et endometrioos põhjustab korduvat raseduse katkemist või et endometrioosi meditsiiniline või kirurgiline ravi vähendab korduva raseduse katkemise esinemissagedust.
Praeguste kontseptsioonide kohaselt seisneb lisaks geneetilistele ja osaliselt nakkuslikele põhjustele, mis viivad ebanormaalse embrüo moodustumiseni, ka teiste tegurite (anatoomiliste, endokriinsete, immunoloogiliste) kahjuliku mõju rakendamine ebasoodsa tausta loomises geneetiliselt täieliku viljastatud munaraku arenguks, mis viib koorioni reservvõimsuse ammendumiseni ja arengu (embrüogeneesi) lakkamiseni. Raseduse esimesel trimestril on kriitilised perioodid 6-8 nädalat (embrüo surm) ja 10-12 nädalat (viljastatud munaraku väljutamine).
 [ 1 ]
[ 1 ]
Harjumuspärase raseduse katkemise geneetilised põhjused
Geneetilised tegurid moodustavad 3–6% harjumuspärase raseduse katkemise põhjustest. Esimesel trimestril juhusliku raseduse katkemise korral on umbes 50% abortidest kromosoomanomaaliad. Enamik neist (95%) on kromosoomide arvu muutused – monosoomia (ühe kromosoomi kaotus), trisoomia (täiendava kromosoomi olemasolu), mis on meioosi vigade tagajärg, samuti polüploidia (kromosoomide koostise suurenemine täieliku haploidse komplekti võrra), mis tekib munaraku viljastamisel kahe või enama spermatosoidiga. Juhuslike raseduse katkemiste korral esineb kõige sagedamini trisoomiat – 60% kõigist mutatsioonidest (kõige sagedamini 16. kromosoomis, samuti 13., 18., 21., 22. kromosoomis), teisel kohal on Šereševski-Turneri sündroom (45. kromosoom X0) – 20%, ülejäänud 15% on tingitud polüploidiast (eriti triploidiast).
Abordi kromosoomide arvu muutuse korral vanemate karüotüübi uurimine enamasti patoloogiat ei näita ning loote kromosomaalse haiguse tõenäosus järgneva raseduse ajal on 1%. Seevastu harjumuspärase raseduse katkemisega paaride abortide uurimisel täheldatakse 3–6% juhtudest kromosoomide struktuurimuutusi (intra- ja interkromosomaalselt). Vanemate karüotüübi uurimisel leitakse tasakaalustatud kromosomaalseid ümberkorraldusi 7% juhtudest. Enamasti on tegemist retsiprooksete translokatsioonidega, kus ühe kromosoomi segment paikneb mittehomoloogse kromosoomi teise segmendi asemel, samuti sugukromosoomide mosaiiksuse, inversiooni ja kromosoomide tuvastamise rõnga kujul. Selliste ümberkorralduste esinemise korral ühel abikaasast on meioosi ajal takistatud kromosoomide paardumise ja eraldumise protsessid, mille tulemuseks on sugurakkudes kromosoomiosade kadumine (deletsioon) või kahekordistumine (duplikatsioon). Selle tulemuseks on nn tasakaalustamata kromosomaalsed ümberkorraldused, mille puhul embrüo on kas elujõuetu või kannab rasket kromosomaalset patoloogiat. Tasakaalustamata kromosomaalsete anomaaliatega lapse saamise tõenäosus ühe vanema karüotüübi tasakaalustatud kromosomaalsete ümberkorralduste korral on 1–15%. Andmete erinevused on seotud ümberkorralduste olemuse, kaasatud segmentide suuruse, kandja soo ja perekonnaanamneesiga.
Diagnostika
Anamnees
- Pärilikud haigused perekonnaliikmetel.
- Kaasasündinud anomaaliate esinemine perekonnas.
- Vaimse alaarenguga laste sünd.
- Viljatuse ja/või teadmata päritoluga raseduse katkemise esinemine abielupaaril või sugulastel.
- Ebaselgete perinataalse suremuse juhtumite esinemine.
Spetsiaalsed uurimismeetodid
- Vanemate karüotüübi uuring on eriti näidustatud abielupaaridele vastsündinu sünnil, kellel on lisaks raseduse katkemisele ka arenguhäireid, samuti harjumuspärase raseduse katkemise korral raseduse algstaadiumis.
- Abordi tsütogeneetiline analüüs surnult sündimise või vastsündinute suremuse korral.
Näidustused teiste spetsialistidega konsulteerimiseks
Kui vanematel avastatakse muutusi karüotüübis, on vajalik geneetiku konsultatsioon, et hinnata patoloogiaga lapse saamise riski astet või vajadusel otsustada munaraku või sperma annetamise küsimuse üle.
Patsiendi edasine ravi
Kui abielupaaril on patoloogiline karüotüüp, isegi ühel vanematest, on loote arenguhäirete suure riski tõttu soovitatav raseduse ajal läbi viia sünnieelne diagnostika - koorionibiopsia või amniotsentees.
Harjumuspärase raseduse katkemise anatoomilised põhjused
Harjumuspärase raseduse katkemise anatoomiliste põhjuste hulka kuuluvad:
- kaasasündinud anomaaliad emaka arengus (emaka täielik kahekordistumine; kahe-, sadula- ja ükssarvikuline emakas; osaline või täielik emakasisene vaheseina);
- omandatud anatoomilised defektid;
- emakasisesed adhesioonid (Ashermani sündroom);
- submukoossed emaka fibroidid;
- ismilise-emakakaela puudulikkus.
Harjumuspärase raseduse katkemisega patsientidel esineb anatoomilisi anomaaliaid 10–16% sagedusega. Emaka väärarengute, mis võivad põhjustada raseduse katkemist (kuid mitte viljatust), esinemissagedus kõigi emaka väärarengute puhul on järgmine: kahesarveline emakas – 37%, sadulakujuline emakas – 15%, emakasisene vahesein – 22%, emaka täielik kahekordistumine – 11%, ükssarvikuline emakas – 4,4%.
Harjumuspärase raseduse katkemise diagnoosimine
Anamnees
Emaka anatoomilise patoloogia korral täheldatakse sagedamini raseduse hilinenud katkemist ja enneaegseid sünnitusi, kuid emakasisese vaheseina või müomatoosse sõlme lähedusse implanteerimisel on võimalik ka raseduse varajane katkestamine.
Ismilise-emakakaela puudulikkuse korral on patognomooniliseks tunnuseks raseduse spontaanne katkestamine teisel trimestril või varajane enneaegne sünnitus, mis toimub suhteliselt kiiresti ja vähese valuga.
Emaka väärarengute korral on vaja pöörata tähelepanu kuseteede patoloogia anamneesidele (sageli kaasnevad need emaka kaasasündinud anomaaliatega) ja menstruaalfunktsiooni arengu olemusele (hematomeetri näidustused koos toimiva emaka rudimentaarse sarvega).
Spetsiaalsed uurimismeetodid
- Praegu tehakse diagnoosi panemiseks hüsterosalpingograafiat, mis võimaldab uurida emakaõõne kuju, tuvastada submukoossete fibroidide, adhesioonide, vaheseinte olemasolu ja määrata munajuhade läbitavust. Emaka patoloogia diagnoosimiseks on otstarbekas teha hüsterosalpingograafiat menstruatsiooni ja ovulatsiooni vahelisel perioodil, st menstruaaltsükli esimeses faasis pärast verise eritise lakkamist (tsükli 7.-9. päev). Ismaatilise-emakakaela puudulikkuse diagnoosimiseks tehakse uuring menstruaaltsükli teises faasis (18.-20. päev), et teha kindlaks emakakaela sisemise suudme seisund. Enne hüsterosalpingograafia tegemist on vaja välistada vaagnaelundite põletikulised haigused või neid ravida.
- Hüstroskoopia on viimastel aastatel laialt levinud ja sellest on saanud emakasisese patoloogia diagnoosimise kuldstandard. Kuna see on aga hüsterosalpingograafiaga võrreldes kõrgema hinnaga, kasutatakse seda meetodit naistel, kellel on esialgsete ultraheliandmete põhjal emakasisese patoloogia näidustus. Hüstroskoopia abil saab uurida emakaõõnt, määrata emakasisese patoloogia olemust ja vajaliku varustuse (resektoskoopi) olemasolul teostada minimaalselt invasiivset kirurgilist ravi - adhesioonide, submukoossete müoomisõlmede ja endomeetriumi polüüpide eemaldamist. Emakasisese vaheseina eemaldamisel eelistatakse laparoskoopilise kontrolliga hüsteroresektoskoopiat, mis hoiab ära emaka seina perforatsiooni võimaluse.
- Ultraheli tehakse menstruaaltsükli esimeses faasis, mis võimaldab diagnoosida submukoosset emakamüoomi ja emakasiseseid adhesioone ning tsükli teises faasis emakasisene vaheseina ja kahesarvelise emaka. See meetod on eriti oluline raseduse algstaadiumis, kui selle tundlikkus nende seisundite diagnoosimisel on 100% ja spetsiifilisus 80%. Väljaspool rasedust vajab diagnoos täiendavat kinnitust teiste meetoditega.
- Välismaised autorid toovad välja sonohüsterograafia (ultraheli transvaginaalse anduri abil, mille eelnev manustamine emakaõõnde on 0,9% naatriumkloriidi lahus) eelise hüsterosalpingograafia ees, kuna see võimaldab diferentsiaaldiagnostikat emakasisese vaheseina ja kahesarvelise emaka vahel. Sonohüsterograafia abil on võimalik uurida mitte ainult emakaõõne kuju, vaid ka määrata emakapõhja konfiguratsiooni. Meie riigis pole see meetod laialt levinud.
- Mõnedel keerukatel juhtudel kasutatakse diagnoosi kinnitamiseks vaagnaelundite magnetresonantstomograafiat (MRI). See meetod võimaldab saada väärtuslikku teavet emaka arenguanomaaliate korral, millega kaasneb vaagnaelundite ebatüüpiline paigutus. MRI on oluline rudimentaarse emakasarve puhul, et otsustada, kas selle eemaldamine on otstarbekas. Rudimentaarse emakasarve eemaldamise vajadus tekib siis, kui see on ühenduses munajuha ja munasarjaga, et vältida viljastatud munaraku moodustumist ja arengut selles. Raseduse katkemine emaka anatoomiliste anomaaliate korral võib olla seotud viljastatud munaraku ebaõnnestunud implantatsiooniga (emakasisesele vaheseinale, submukoosse müoomisõlme lähedale), endomeetriumi ebapiisavalt arenenud vaskularisatsiooni ja vastuvõtuga, tihedate ruumiliste suhetega emakaõõnes (näiteks müoomisõlme poolt tekitatud õõnsuse deformatsiooni korral), millega sageli kaasneb invasioon, ja hormonaalsete häiretega.
Harjumuspärase raseduse katkemise ravi
Kirurgiline ravi
Emakasisese vaheseina, submukoossete müoomisõlmede ja adhesioonide korral on kõige efektiivsem kirurgiline ravi hüsteroresektoskoopia. Hilisemate raseduse katkemiste sagedus selles naisterühmas pärast ravi on 10% võrreldes 90%-ga enne operatsiooni. Laparotoomia ja transtservikaalse hüsteroresektoskoopia abil teostatud metroplastika tulemuste võrdlemisel sai P. Heinonen (1997) tulemused, mis näitasid hüsteroresektoskoopia väiksemat traumat ja suuremat efektiivsust; elujõuliste laste sünniga lõppenud raseduste osakaal oli vastavalt 68 ja 86%.
Emakasisese vaheseina, adhesioonide ja submukoossete müoomisõlmede kirurgiline eemaldamine välistab raseduse katkemise 70–80% juhtudest. See on aga ebaefektiivne naistel, kellel on emaka väärarengud ja kellel on olnud normaalne sünnitus koos järgnevate korduvate raseduse katkemistega. On tõenäoline, et sellistel juhtudel ei ole anatoomiline tegur peamine põhjus ja tuleb otsida teisi raseduse katkemise põhjuseid.
On tõestatud, et kõhu metroplastika on seotud märkimisväärse postoperatiivse viljatuse riskiga ega paranda järgneva raseduse prognoosi. Seetõttu on parem eelistada hüstroskoopiat ja laparoskoopilist operatsiooni.
Narkootikumide ravi
IUDi, östrogeensete ravimite suurte annuste, Foley kateetri emakaõõnde sisestamise efektiivsust pärast adhesioonide eemaldamise operatsioone ja emakasisese vaheseina eemaldamist ei ole tõestatud. Rasedust on soovitatav planeerida mitte varem kui 3 kuud pärast operatsiooni. Endomeetriumi kasvu parandamiseks viiakse tsükliline hormoonravi läbi 3 menstruaaltsükli jooksul [14]. Tsükli esimese 14 päeva jooksul on 3 kuu jooksul soovitatav võtta ravimit, mis sisaldab 2 mg 17-beeta-östradiooli, järgmise 14 päeva jooksul - 2 mg 17-beeta-östradiooli ja 20 mg düdrogesterooni (10 mg düdrogesterooni kombineeritud ravimi osana pluss 10 mg düdrogesterooni eraldi tableti kujul).
Patsiendi edasine ravi
Kahe sarvjas emaka või emaka kahekordistumise (kui on kaks emakaõõnt) raseduse kulgu iseloomustavad tunnused:
- raseduse algstaadiumis tekib verejooks sageli "tühjast" sarvest või emakaõõnest tänu väljendunud detsiduaalsele reaktsioonile; taktika peaks sel juhul olema konservatiivne ja koosnema spasmolüütiliste ja hemostaatiliste ainete kasutamisest;
- raseduse katkemise oht erinevates etappides;
- ismilise-emakakaela puudulikkuse areng;
- platsenta puudulikkusest tingitud emakasisene kasvupeetus.
Raseduse algstaadiumis on verejooksu korral soovitatav voodi- ja poolvoodirežiim, samuti hemostaatiliste, spasmolüütiliste ja rahustavate ravimite manustamine ning ravi gestageenidega (düdrogesteroon päevases annuses 20–40 mg) kuni 16–18 rasedusnädalani.
Harjumuspärase raseduse katkemise endokriinsed põhjused
Erinevate autorite andmetel moodustavad raseduse katkemise endokriinsed põhjused 8–20%. Neist olulisemad on luteaalfaasi puudulikkus (LPD), LH hüpersekretsioon, kilpnäärme talitlushäired ja suhkurtõbi.
Raske kilpnäärmehaigus või suhkurtõbi võib põhjustada korduvaid raseduse katkemisi. Kompenseeritud suhkurtõve korral ei erine harjumuspäraste raseduse katkemiste risk aga üldpopulatsioonist.
Samal ajal nõuab hüpotüreoidismi kõrge esinemissagedus populatsioonis skriiningut TSH taseme mõõtmisega. Harjumuspärase raseduse katkemisega patsientidel täheldatakse luteaalfaasi puudulikkust 20–60% juhtudest ja polütsüstiliste munasarjade ultraheliuuringu tunnuseid 44–56% juhtudest. Kirjanduse andmetel on üksikute hormonaalsete häirete mõju harjumuspärase raseduse katkemise sümptomite kompleksi tekkele endiselt vastuoluline. M. Ogasawara jt (1997) uuringud ei näidanud usaldusväärseid erinevusi raseduse katkemise sageduses LPI-ga ja ilma patsientidel, kellel on anamneesis kaks või enam varasemat raseduse katkemist, välja arvatud autoimmuunsed, anatoomilised ja nakkuslikud põhjused.
Kollaskeha funktsiooni puudulikkus võib olla mitmete ebasoodsate tegurite tagajärg:
- FSH ja LH sekretsiooni häired menstruaaltsükli esimeses faasis;
- LH vabanemise varajane või vastupidi liiga hiline tipphetk;
- hüpoöstrogeenilisus ebapiisava follikulogeneesi tagajärjel. Kõiki neid seisundeid ei saa postovulatoorsel perioodil gestageenravimitega asendusravi abil korrigeerida. L. Regani jt läbi viidud prospektiivsed uuringud näitasid menstruaaltsükli 8. päeval LH hüpersekretsiooniga patsientidel raseduse katkemise sageduse olulist suurenemist võrreldes naistega, kelle LH tase veres oli normaalne (vastavalt 65% ja 12% raseduse katkemistest). LH enneaegse tõusu kahjulik mõju on seotud teise meiootilise jagunemise enneaegse taastumisega ja ebaküpse munaraku ovulatsiooniga, samuti androgeeni tootmise indutseerimisega theca-rakkude poolt koos endomeetriumi vastuvõtu halvenemisega gestageenpuudulikkuse mõjul. Siiski ei anna preovulatoorse LH taseme esialgne vähendamine gonadotropiini vabastava hormooni agonistidega ilma täiendavate meetmeteta, mille eesmärk on pikendada järgnevat rasedust, oodatud raseduse katkemise sageduse vähenemist.
NLF-i diagnoosimise kuldstandardiks on endomeetriumi biopsia käigus saadud materjali histoloogiline uuring tsükli teises faasis kahe menstruaaltsükli jooksul.
Ovulatoorse düsfunktsiooni muude põhjuste, näiteks hüperprolaktineemia, hüpotüreoidismi, androgeenide (munasarjade või neerupealiste) funktsionaalse liigse sisalduse diagnoosimisel peab kaasnema sobiva ravi määramine.
Diagnostika
Anamnees ja füüsiline läbivaatus
- Anamnees. Arvesse võetavad tegurid: hiline menstruatsioon, ebaregulaarne menstruaaltsükkel (oligomenorröa, amenorröa, järsk kaalutõus, kaalulangus, viljatus, harjumuspärased varased raseduse katkemised).
- Uuring: kehatüüp, pikkus, kehakaal, hirsutism, teiseste sugutunnuste raskusaste, striiade olemasolu, piimanäärmete uuring galaktorröa suhtes.
- Funktsionaalsed diagnostilised testid: rektaalse temperatuuri mõõtmine kolme menstruaaltsükli jooksul.
Spetsiaalsed uurimismeetodid
- Hormonaalne uuring:
- menstruaaltsükli esimeses faasis (7.–8. päeval) – FSH, LH, prolaktiini, TSH, testosterooni, 17-hüdroksüprogesterooni (17-OP), DHEAS sisalduse määramine;
- menstruaaltsükli teises faasis (21–22 päeva) – progesterooni sisalduse määramine (progesterooni taseme normatiivsed näitajad on väga varieeruvad, meetodit ei saa kasutada ilma teisi tegureid arvesse võtmata).
- Ultraheli:
- menstruaaltsükli esimeses faasis (5.–7. päev) – endomeetriumi patoloogia, polütsüstiliste munasarjade diagnoosimine;
- menstruaaltsükli teises faasis (20–21 päeva) – endomeetriumi paksuse mõõtmine (normaalne 10–11 mm, korreleerub progesterooni sisaldusega).
- Endomeetriumi biopsia NLF-i kinnitamiseks tehakse 2 päeva enne eeldatavat menstruatsiooni (26. päeval 28-päevase tsükli korral). Seda meetodit kasutatakse juhtudel, kui diagnoos on ebaselge. Endomeetriumi muutuste uurimiseks nn implantatsiooniakna perioodil tehakse biopsia 6. päeval pärast ovulatsiooni.
Ravi
NLF-i diagnoosimisel (vastavalt rektaalse temperatuuri diagrammidele on 2. faasi kestus alla 11 päeva, täheldatakse järkjärgulist temperatuuri tõusu, endomeetriumi biopsia andmetel endomeetriumi ebapiisavat sekretoorset transformatsiooni, madalat progesterooni taset vereseerumis) on vaja välja selgitada selliste häirete põhjus.
Kui NLF-iga kaasneb hüperprolaktineemia, tehakse aju magnetresonantstomograafia (MRI). Alternatiivseks meetodiks on kolju (turki kaelapiirkonna) röntgenülesvõte.
Hüperprolaktineemia esimene etapp on hüpofüüsi adenoomi välistamine, mis nõuab kirurgilist ravi. Oluliste muutuste puudumisel peetakse hüperprolaktineemiat funktsionaalseks ja prolaktiini taseme normaliseerimiseks määratakse bromokriptiinravi. Bromokriptiini algannus on 1,25 mg/päevas 2 nädala jooksul, pärast prolaktiini taseme jälgimist, kui näitajad ei normaliseeru, suurendatakse annust 2,5 mg-ni päevas. Prolaktiini taseme olulise suurenemise korral on algannus 2,5 mg/päevas. Raseduse korral tuleb bromokriptiini kasutamine lõpetada.
Hüpotüreoidismi avastamisel määratakse koos endokrinoloogiga kilpnäärme patoloogia olemus. Igal juhul on näidustatud igapäevane naatriumlevotüroksiinravi, annus valitakse individuaalselt kuni TSH taseme normaliseerumiseni. Raseduse korral tuleb naatriumlevotüroksiinravi jätkata. Annuse suurendamise otstarbekuse küsimus raseduse esimesel trimestril otsustatakse koos endokrinoloogiga pärast hormonaalse uuringu tulemuste (TSH tase, vaba türoksiin) saamist.
NLF-i korrigeerimine toimub kahel viisil. Esimene viis on ovulatsiooni stimuleerimine, teine viis on asendusravi progesterooni preparaatidega.
Esimene ravivõimalus on ovulatsiooni stimuleerimine klomifeentsitraadiga. See ravimeetod põhineb asjaolul, et enamik luteaalfaasi häireid tekib tsükli follikulaarses faasis. Pidevalt langenud progesterooni tase teises faasis on tingitud follikulogeneesi häirest tsükli esimeses faasis. Seda häiret saab edukalt korrigeerida klomifeentsitraadi väikeste annustega follikulaarse faasi alguses kui progesterooni määramisega tsükli teises faasis.
1. tsüklis on klomifeentsitraadi annus 50 mg/päevas menstruaaltsükli 5. kuni 9. päevani. Efektiivsust jälgitakse rektaaltemperatuuri mõõtvate diagrammide, progesterooni taseme mõõtmise abil tsükli 2. faasis või dünaamilise ultraheli abil. Kui ovulatsiooni stimuleerimise 2. tsüklis ei ole piisavat efekti, tuleb klomifeentsitraadi annust suurendada 100 mg-ni/päevas tsükli 5. kuni 9. päevani. Maksimaalne võimalik annus ovulatsiooni stimuleerimise 3. tsüklis on 150 mg/päevas. Selline annuse suurendamine on võimalik ainult siis, kui ravim on hästi talutav (puudub tugev valu alakõhus ja alaseljas ning muud munasarjade hüperstimulatsiooni tunnused).
Teine ravivõimalus: asendusravi progesteroonipreparaatidega, mis soodustavad endomeetriumi täielikku sekretoorset transformatsiooni, mis annab vajaliku efekti patsientidel, kellel on harjumuspärane raseduse katkemine koos säilinud ovulatsiooniga. Lisaks on viimastel aastatel kindlaks tehtud, et progesteroonipreparaatide manustamisel on lisaks hormonaalsele ka immunomoduleerivale toimele, mis pärsib endomeetriumi immunokompetentsete rakkude äratõukereaktsioone. Eelkõige on sarnast toimet kirjeldatud dihüdrogesterooni puhul annuses 20 mg päevas. Asendusravi eesmärgil kasutatakse düdrogesterooni suukaudselt annuses 20 mg päevas või mikroniseeritud progesterooni vaginaalselt annuses 200 mg päevas. Ravi viiakse läbi 2. päeval pärast ovulatsiooni (päev pärast rektaaltemperatuuri tõusu) ja kestab 10 päeva. Raseduse korral tuleb ravi progesteroonipreparaatidega jätkata.
Kaasaegsed uuringud ei ole kinnitanud inimese kooriongonadotropiini efektiivsust korduva raseduse katkemise ravis.
Hüperandrogenismi (munasarja- või neerupealise päritolu) korral patsientidel, kellel esineb harilik raseduse katkemine, on näidustatud ravimravi androgeenide mõju tõttu ovulatsiooni täielikkusele ja endomeetriumi seisundile. Neerupealiste androgeenide biosünteesi rikkumise korral on võimalik nende viriliseeriv toime naissoost lootele, seetõttu viiakse loote huvides läbi steroidravi.
Munasarjade hüperandrogenism (polütsüstilised munasarjad)
Anamnees, füüsiline läbivaatus ja eriuuringute tulemused
- Anamnees: hiline menarhe, menstruaaltsükli häired, näiteks oligomenorröa (tavaliselt primaarne, harvemini sekundaarne). Rasedus on haruldane, katkeb tavaliselt spontaanselt esimesel trimestril, raseduste vahel on pikad viljatuse perioodid.
- Uuring: hirsutism, akne, venitusarmid, kõrge kehamassiindeks (valikuline).
- Rektaalse temperatuuri diagrammid: anovulatoorsed tsüklid vahelduvad ovulatsiooni ja NLF-i tsüklitega.
- Hormonaalne uuring: kõrge testosterooni tase, FSH ja LH tasemed võivad olla tõusnud, LH/FSH suhe on suurem kui 3. Ultraheli: polütsüstilised munasarjad.
Ravi
Ravimivaba ravi
Kaalulangus - dieediteraapia, füüsiline aktiivsus.
Narkootikumide ravi
- Orlistaat annuses 120 mg iga peamise söögikorra ajal. Kuuri kestus määratakse, võttes arvesse toimet ja talutavust.
- Esialgne testosterooni vähendamine tsüproteroonatsetaati (2 mg) ja EE-d (35 mcg) sisaldavate preparaatidega 3 menstruaaltsükli jooksul.
- Rasestumisvastaste vahendite ärajätmine, tsükli teise faasi hormonaalne toetamine (gestageenravi) - düdrogesteroon annuses 20 mg/päevas menstruaaltsükli 16. kuni 25. päevani. Kui spontaanset ovulatsiooni ei toimu, jätkake järgmise etapiga.
- Ovulatsiooni stimuleerimine klomifeentsitraadiga algannuses 50 mg päevas menstruaaltsükli 5. kuni 9. päevani koos samaaegse raviga gestageenidega (düdrogesteroon annuses 20 mg päevas tsükli 16. kuni 25. päevani) ja deksametasooniga (0,5 mg).
- Raseduse puudumisel suurendatakse klomifeentsitraadi annust 100–150 mg-ni päevas koos gestageenide manustamisega tsükli teises faasis ja deksametasooniga (0,5 mg). On kindlaks tehtud, et kuigi deksametasoon vähendab ainult neerupealiste androgeenide taset, toimub ovulatsioon ja rasestumine klomifeentsitraadi ja deksametasooniga ravimisel oluliselt sagedamini kui ainult klomifeentsitraadi kasutamisel [12].
- Tehakse kolm ovulatsiooni stimuleerimise tsüklit, mille järel on soovitatav teha kolme menstruaaltsükli paus gestageense toega ja otsustada kirurgilise ravi üle laparoskoopilise juurdepääsu abil (munasarjade kiilukujuline resektsioon, laseraurustamine).
Patsiendi edasine ravi
Raseduse jälgimisega peaks kaasnema gestageenset tuge kuni 16. rasedusnädalani (düdrogesteroon annuses 20 mg/päevas või mikroniseeritud progesteroon annuses 200 mg/päevas), deksametasooni määratakse ainult raseduse esimesel trimestril. Istmo-emakakaela puudulikkuse õigeaegseks diagnoosimiseks ja vajadusel selle kirurgiliseks korrigeerimiseks on jälgimine kohustuslik.
Neerupealiste hüperandrogenism (puberteedi- ja postpuberteedijärgne adrenogenitaalne sündroom)
Adrenogenitaalne sündroom (AGS) on pärilik haigus, mis on seotud neerupealise koore hormoonide sünteesi häirega, mis on tingitud mitmete ensüümsüsteemide sünteesi eest vastutavate geenide kahjustusest. Haigus pärandub autosomaalselt retsessiivselt, mutantsed geenid kanduvad edasi mõlemalt vanemalt, kes on terved kandjad.
90% juhtudest on adrenogenitaalse sündroomi põhjustajaks CYP21B geeni mutatsioonid, mis põhjustavad 21-hüdroksülaasi sünteesi häireid.
Anamnees, füüsiline läbivaatus ja eriuuringute tulemused
- Anamnees: hiline menstruatsioon, veidi pikenenud menstruaaltsükkel, võimalik oligomenorröa, spontaansed abordid esimesel trimestril, võimalik viljatus.
- Uuring: akne, hirsutism, androidne kehatüüp (laiad õlad, kitsas vaagen), kliitori hüpertroofia.
- Rektaalse temperatuuri diagrammid: anovulatoorsed tsüklid vahelduvad ovulatsiooni ja NLF-i tsüklitega.
- Hormonaalne test: kõrge 17-OP, DHEAS tase.
- Ultraheli: munasarjad on muutumatud.
Raseduseväline patognomooniline märk on 17-OP kontsentratsiooni suurenemine vereplasmas.
Praegu kasutatakse neerupealiste hüperandrogenismi latentse, mitteklassikalise vormi diagnoosimiseks AKTH-ga testi. Selleks testiks kasutatakse Synactheni - sünteetilist polüpeptiidi, millel on endogeense AKTH omadused, st see stimuleerib neerupealistes kolesteroolist steroidhormoonide sünteesi algfaase.
Synactheni test (AKTH analoog): 1 ml (0,5 mg) Synactheni süstitakse naha alla õlga, esmalt määratakse hommikuses 9 tunni möödudes võetud vereplasmaproovis 17-OP ja kortisooli algsisaldus. 9 tundi pärast süstimist võetakse kontrollvereproov 17-OP ja kortisooli taseme määramiseks. Seejärel arvutatakse määramisindeks (D) järgmise valemi abil:
D = 0,052 × 17-OP + 0,005 × kortisool/17-OP – 0,018 × kortisool/17-OP
Kui D-koefitsient on väiksem või võrdne 0,069-ga, näitab see neerupealiste hüperandrogenismi puudumist. Kui D-koefitsient on suurem kui 0,069, tuleks arvestada, et hüperandrogenismi põhjustab neerupealiste düsfunktsioon.
Narkootikumide ravi
21-hüdroksülaasi puudulikkusest tingitud hüperandrogenismi ravis on peamiseks vahendiks glükokortikoidid, mida kasutatakse liigse androgeeni sekretsiooni pärssimiseks.
Patsiendi edasine ravi
Ema androgeenide viriliseeriva toime tõttu lootele ja neerupealiste hüperandrogenismi diagnoosi korral määratakse enne rasedust deksametasooniga ravi algannuses 0,25 mg ja jätkatakse individuaalselt valitud annuses (0,5–1 mg) kogu raseduse vältel. Harjumuspärase raseduse katkemisega naisel, kes kannatab neerupealiste hüperandrogenismi all, ei ole ravi katkestamine kohane, kuna raseduse katkemise sagedus ravi puudumisel ulatub 14%-ni ja jätkamisel 9%-ni.
Arvestades asjaolu, et adrenogenitaalse sündroomiga patsiendid võivad selle geeni lootele edasi anda, on vaja läbi viia sünnieelne diagnostika: 17.–18. rasedusnädalal tehakse vereanalüüs, et määrata ema organismis 17-OP sisaldust. Kui hormooni tase veres on suurenenud, määratakse selle kontsentratsioon lootevees. Kui 17-OP sisaldus lootevees on suurenenud, diagnoositakse lootel adrenogenitaalne sündroom. Kahjuks ei ole adrenogenitaalse sündroomi raskusastet (kerge või soolasid raiskav raske vorm) võimalik lootevees sisalduva 17-OP taseme järgi kindlaks teha. Raseduse säilitamise küsimuse sellises olukorras otsustavad vanemad.
Kui lapse isa on adrenogenitaalse sündroomi geeni kandja ja perekonnas on esinenud selle sündroomiga laste sündi, siis patsiendile, isegi ilma neerupealiste hüperandrogenismita, manustatakse loote huvides deksametasooni (naissoost loote virilisatsiooni vältimiseks) annuses 20 mcg/kg kehakaalu kohta, maksimaalselt 1,5 mg/päevas 2-3 annusena pärast sööki. 17-18 nädalal, pärast loote soo ja adrenogenitaalse sündroomi geeni ekspressiooni kindlaksmääramist (lootevee uuringu tulemuste põhjal), jätkatakse ravi raseduse lõpuni, kui loode on adrenogenitaalse sündroomiga tüdruk. Kui loode on poiss või tüdruk, kes ei ole adrenogenitaalse sündroomi geeni kandja, võib deksametasooni manustamise lõpetada.
Kui hariliku raseduse katkemisega naisel esineb neerupealiste hüperandrogenism, viiakse deksametasooniravi läbi kogu raseduse vältel ja see lõpetatakse alles pärast sünnitust. 3. päeval pärast sünnitust vähendatakse deksametasooni annust järk-järgult (0,125 mg iga 3 päeva järel) kuni täieliku lõpetamiseni sünnitusjärgsel perioodil.
Segatüüpi hüperandrogenism (munasarjade ja neerupealiste oma)
Anamnees, füüsiline läbivaatus ja eriuuringute tulemused
- Anamnees: hiline menarhe, menstruaaltsükli häired nagu oligomenorröa (tavaliselt primaarne, harvemini sekundaarne), amenorröa, võimalikud vigastused, põrutused. Rasedusi esineb harva, tavaliselt katkeb spontaanselt esimesel trimestril, raseduste vahel on pikad viljatuse perioodid.
- Füüsiline läbivaatus: hirsutism, akne, striiad, mustad akantoosid, kõrge kehamassiindeks, hüpertensioon.
- Rektaalse temperatuuri diagrammid: anovulatoorsed tsüklid vahelduvad ovulatsiooni ja NLF-i tsüklitega.
- Hormonaalsed uuringud: kõrge testosterooni tase, FSH ja LH tasemed võivad olla tõusnud, LH/FSH suhe suurem kui 3, kõrge DHEAS, 17-OP tase, võib esineda hüperprolaktineemia.
- Ultraheli: polütsüstilised munasarjad.
- Elektroentsefalograafia: aju bioelektrilise aktiivsuse muutuste mõõtmine.
- Hüperinsulineemia, lipiidide ainevahetushäired (kõrge kolesteroolitase, madala tihedusega lipoproteiinid ja väga madala tihedusega lipoproteiinid), glükoositaluvuse vähenemine või kõrgenenud veresuhkru tase.
Ravi
Ravimivaba ravi
Kaalulangus (madala kalorsusega dieet, füüsiline aktiivsus).
Narkootikumide ravi
Esimene etapp - insuliiniresistentsuse korral on insuliinitundlikkuse suurendamiseks soovitatav määrata metformiini päevases annuses 1000-1500 mg.
Teine etapp - raskete menstruaaltsükli häirete ja kõrge testosterooni taseme korral on soovitatav 3 kuu jooksul välja kirjutada antiandrogeense toimega ravimeid, mis sisaldavad tsüproteroonatsetaati (2 mg) ja etünüülöstradiooli (35 mcg).
Kolmas etapp on ovulatsiooni stimuleerimine, millele järgneb gestageenset tuge (skeem on kirjeldatud eespool) ja deksametasooni võtmine päevases annuses 0,25–0,5 mg.
Hüperprolaktineemia ja hüpotüreoidismi korral tuleb ovulatsiooni stimulatsioonitsüklites teha sobiv ravimikorrektsioon. Raseduse korral tuleb bromokriptiini kasutamine lõpetada ja levotüroksiini võtmist jätkata.
Kui ovulatsiooni stimuleerimine on ebaefektiivne, tuleks otsustada otsese ovulatsiooni indutseerija määramise, polütsüstiliste munasarjade kirurgilise ravi või in vitro viljastamise otstarbekuse üle.
Patsiendi edasine ravi
Metaboolse sündroomiga patsientidel raskendab rasedust sageli arteriaalne hüpertensioon, nefropaatia, hüperkoagulatsioon, millega seoses on vaja jälgida vererõhku, hemostaasogramme raseduse algstaadiumis ja korrigeerida tekkivaid häireid (vajadusel) antihüpertensiivsete ravimite, trombotsüütidevastaste ainete ja antikoagulantidega. Gestageenset ravimit määratakse kuni 16. rasedusnädalani - didrogesterooni annuses 20 mg päevas või mikroniseeritud progesterooni annuses 200 mg päevas kahes annuses.
Kõik hüperandrogenismiga naised on istmia-emakakaela puudulikkuse riskirühm. Emakakaela seisundi jälgimine peaks toimuma alates 16. rasedusnädalast ja vajadusel istmia-emakakaela puudulikkuse kirurgiline korrigeerimine.
Harjumuspärase raseduse katkemise immunoloogilised põhjused
Praegu on teada, et umbes 80% kõigist varem seletamatutest korduvatest raseduse katkemistest (pärast geneetiliste, anatoomiliste ja hormonaalsete põhjuste välistamist) on seotud immuunhäiretega. Eristatakse autoimmuunseid ja alloimmuunseid häireid, mis viivad harjumuspärase raseduse katkemiseni.
Autoimmuunprotsesside puhul satuvad immuunsüsteemi enda koed agressiooni objektiks ehk immuunvastus on suunatud omaenda antigeenide vastu. Sellises olukorras kannatab loode sekundaarselt ema kudede kahjustuse tagajärjel.
Alloimmuunhaiguste korral on naise immuunvastus suunatud isalt saadud embrüonaalsete/loote antigeenide vastu, mis on ema organismile potentsiaalselt võõrad.
Harjumuspärase raseduse katkemisega patsientidel esinevate autoimmuunhaiguste hulka kuuluvad antifosfolipiidide, kilpnäärmevastaste ja tuumavastaste autoantikehade esinemine seerumis. Seega on kindlaks tehtud, et 31%-l naistest, kellel on harilik raseduse katkemine väljaspool rasedust, esinevad türeoglobuliini ja kilpnäärme peroksidaasi vastased autoantikehad (kilpnäärme mikrosomaalsed [kilpnäärme peroksidaasi] autoantikehad); nendel juhtudel suureneb spontaanse raseduse katkemise risk raseduse esimesel trimestril 20%-ni. Hariliku raseduse katkemise korral viitab tuumavastaste ja kilpnäärmevastaste antikehade esinemine vajadusele täiendavate uuringute järele autoimmuunprotsessi tuvastamiseks ja diagnoosi kinnitamiseks.
Antifosfolipiidide sündroom (APS) on endiselt üldiselt tunnustatud autoimmuunhaigus, mis viib embrüo/loote surmani.
Alloimmuunhaigused
Praegu hõlmavad loote hülgamisreaktsiooni põhjustavad alloimmuunprotsessid abikaasade suurenenud (rohkem kui 3) arvu ühiste antigeenide esinemist peamise histosobivuskompleksi süsteemis (sageli täheldatakse sugulusabieludes); madal blokeerivate faktorite tase ema seerumis; looduslike tapjarakkude (NK-rakud CD56, CD16) taseme tõus ema endomeetriumis ja perifeerses veres nii raseduse ajal kui ka väljaspool seda; mitmete tsütokiinide, eriti γ-interferooni, tuumorinekroosifaktori a, interleukiinide-1 ja 2 kõrge kontsentratsioon endomeetriumis ja vereseerumis.
Praegu uuritakse alloimmuunseid tegureid, mis põhjustavad varajast raseduse katkemist, ja viise nende seisundite korrigeerimiseks. Ravimeetodite osas puudub üksmeel. Mõnede teadlaste sõnul ei anna aktiivne immuniseerimine doonorlümfotsüütidega olulist efekti, samas kui teised autorid kirjeldavad sellise immuniseerimise ja immunoglobuliinidega ravi olulist positiivset mõju.
Praegu on üks immunomoduleerivatest ainetest raseduse alguses progesteroon. Eelkõige on uuringud tõestanud düdrogesterooni rolli päevases annuses 20 mg naistel, kellel esineb harilik raseduse katkemine raseduse esimesel trimestril, kui endomeetriumis on suurenenud CD56 rakkude tase.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Geneetiliselt määratud trombofiiliad
Järgmisi geneetiliselt määratud trombofiilia vorme peetakse raseduse ajal esinevateks trombofiilseteks seisunditeks, mis viivad harjumuspärase raseduse katkemiseni.
- Antitrombiin III puudulikkus.
- V faktori mutatsioon (Leideni mutatsioon).
- C-valgu puudus.
- S-valgu puudus.
- Protrombiini geeni mutatsioon G20210A.
- Hüperhomotsüsteineemia.
Haruldaste trombofiilia põhjuste väljaselgitamiseks on vajalik uuring juhtudel, kui esines:
- perekonna ajalugu - trombemboolia enne 40. eluaastat sugulastel;
- usaldusväärsed venoosse ja/või arteriaalse tromboosi episoodid enne 40. eluaastat;
- korduv tromboos patsiendil ja tema lähisugulastel;
- trombemboolsed tüsistused raseduse ajal ja pärast sünnitust hormonaalsete rasestumisvastaste vahendite kasutamisel;
- korduvad raseduse katkemised, surnult sündimised, emakasisene kasvupeetus, platsenta irdumine;
- varajane preeklampsia, HELLP sündroom.
Harjumuspärase raseduse katkemise nakkuslikud põhjused
Nakkusfaktori rolli hariliku raseduse katkemise põhjusena arutatakse praegu laialdaselt. On teada, et primaarne infektsioon raseduse algstaadiumis võib põhjustada embrüole eluga kokkusobimatuid kahjustusi, mis viib juhuslike spontaansete raseduse katkemisteni. Siiski on nakkuse taasaktiveerumise tõenäosus samaaegselt korduvate raseduse katkemiste tagajärgedega tühine. Lisaks ei ole praegu leitud mikroorganisme, mis provotseeriksid harilikku raseduse katkemist. Viimaste aastate uuringud on näidanud, et enamikul hariliku raseduse katkemise ja kroonilise endometriidiga naistel on endomeetriumis 2-3 või enam tüüpi obligaatseid anaeroobseid mikroorganisme ja viirusi.
V. M. Sidelnikova jt andmetel kinnitati harjumuspärase raseduse katkemisega naistel kroonilise endometriidi diagnoos histoloogiliselt 73,1% juhtudest ning 86,7% juhtudest täheldati oportunistlike mikroorganismide püsimist endomeetriumis, mis võib kindlasti olla immunopatoloogiliste protsesside aktiveerumise põhjuseks. Segatüüpi püsivat viirusinfektsiooni (herpes simplex viirus, Coxsackie A, Coxsackie B, enteroviirused 68–71, tsütomegaloviirus) leidub harjumuspärase raseduse katkemisega patsientidel oluliselt sagedamini kui naistel, kellel on normaalne sünnitusajalugu. K. Kohut jt (1997) näitasid, et primaarse korduva raseduse katkemisega patsientidel on endomeetriumi ja detsiduaalkoe põletikuliste muutuste protsent oluliselt suurem kui naistel pärast raseduse katkemist, kellel on olnud vähemalt üks täisajaline sünnitus.
Endomeetriumi bakteriaalne ja viiruslik koloniseerimine tuleneb tavaliselt immuunsüsteemi ja keha mittespetsiifiliste kaitsejõudude (komplemendisüsteem, fagotsütoos) võimetusest nakkusetekitajat täielikult elimineerida ning samal ajal piirab selle levikut T-lümfotsüütide (T-abistajad, looduslikud tapjarakud) ja makrofaagide aktivatsioon. Kõigil ülaltoodud juhtudel toimub mikroorganismide püsimine, mida iseloomustab mononukleaarsete fagotsüütide, looduslike tapjarakkude, T-abistajate, mis sünteesivad mitmesuguseid tsütokiine, ligitõmbumine kroonilise põletiku piirkonda. Ilmselt takistab endomeetriumi selline seisund lokaalse immunosupressiooni teket preimplantatsiooniperioodil, mis on vajalik kaitsva barjääri moodustamiseks ja poolvõõra loote äratõukereaktsiooni vältimiseks.
Sellega seoses tuleks enne rasedust naistel, kellel esineb harilik raseduse katkemine, diagnoosida krooniline endometriit. Selle diagnoosi kinnitamiseks või välistamiseks tehakse menstruaaltsükli 7.-8. päeval endomeetriumi biopsia koos histoloogilise uuringu, PCR-i ja emakaõõnest võetud materjali bakterioloogilise uuringuga. Diagnoosi kinnitamisel ravitakse kroonilist endometriiti vastavalt vaagnaelundite põletikuliste haiguste ravi standarditele.

