Artikli meditsiiniline ekspert
Uued väljaanded
Osteoartriidi eksperimentaalsed mudelid
Viimati vaadatud: 07.07.2025

Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
Kõhr on kõrgelt spetsialiseerunud kude, mis sisaldab ainult ühte tüüpi rakke (kondrotsüüte) ja mida iseloomustab vere- ja lümfisoonte puudumine. Kõhr toitub peamiselt sünoviaalvedelikust imendumise teel. Kondrotsüütide ainevahetust reguleerivad mitmed lahustuvad faktorid, mida kondrotsüütide ja ümbritsevate kudede poolt lokaalselt toodetakse. Kondrotsüütide funktsioon sõltub ka rakuvälise keskkonna koostisest (hapnikupinge, ioonide kontsentratsioon, pH jne), rakuvälise maatriksi koostisest, rakkude ja maatriksi vastastikmõjust ning füüsikalistest signaalidest. Eksperimentaalse modelleerimise peamine eesmärk on luua kultuure rakuvälises keskkonnas, muutmata küpsete rakkude fenotüüpi. Teine eesmärk on luua kultuure, et uurida kondrotsüütide enneaegset, hilinenud, lühiajalist või pikaajalist reageerimist keemilistele ja/või füüsikalistele signaalidele. In vitro uuringud pakuvad ka võimalust uurida kondrotsüütide käitumist osteoartroosi korral. Kolmas eesmärk on töötada välja koekultuurisüsteemid, mis võimaldavad uurida liigese erinevate kudede interaktsioone. Neljas ülesanne on kõhreimplantaatide ettevalmistamine järgnevaks siirdamiseks. Ja lõpuks, viies ülesanne on uurida kasvufaktoreid, tsütokiine või terapeutilisi aineid, mis on võimelised stimuleerima paranemist ja/või pärssima kõhre resorptsiooni.
Viimaste aastakümnete jooksul on loodud mitmesuguseid liigesekõhre rakukultuuride mudeleid, sealhulgas monokihikultuurid, suspensioonkultuurid, kondronikultuurid, eksplantaadid, kokultuurid ja immortaliseeritud rakukultuurid. Igal kultuuril on oma eelised ja puudused ning igaüks neist sobib kondrotsüütide metabolismi ühe konkreetse aspekti uurimiseks. Seega on kõhreeksplantaadid suurepärane mudel maatriksielementide käibe uurimiseks, mis nõuab ehtsaid rakupinna retseptoreid ning normaalseid rakkude ja maatriksi ning maatriksi ja rakkude vastastikmõjusid. Samal ajal on soovitatav uurida maatriksi ladestumist või kondrotsüütide metabolismi reguleerivaid mehhanisme isoleeritud rakkude kultuuril. Madala tihedusega monokihikultuur on vajalik rakkude diferentseerumisprotsessi uurimiseks. Looduslikus või sünteetilises maatriksis suspensioonkultuurid on mudel kondrotsüütide adaptiivse reaktsiooni analüüsimiseks mehaanilisele stressile.
Kondrotsüütide kultuurid
In vitro uuringuteks kõhrkoe valimisel tuleks arvesse võtta mitmeid olulisi punkte. Kondrotsüütide maatriksi koostis ja metaboolne aktiivsus on liigeste lõikes erinevad ning viimane sõltub ka kondrotsüütide paiknemise sügavusest koes. Need andmed saadi mitmetes katsetes, milles uuriti erineva sügavusega kõhrevöönditest eraldatud kondrotsüütide alampopulatsioone. Liigesekõhre pindmistes ja sügavates kihtides paiknevate kultiveeritud kondrotsüütide vahel leiti mitmeid morfoloogilisi ja biokeemilisi erinevusi. Pindmised rakud sünteesivad hõredat, proteoglükaanivaest fibrillaarset maatriksit, samas kui sügavamad rakud toodavad fibrillide ja proteoglükaanide poolest rikast maatriksit. Lisaks toodavad pindmised rakud suhteliselt rohkem väikeseid mitteagregeerunud proteoglükaane ja hüaluroonhapet ning suhteliselt vähem agrekaani ja keratansulfaati kui sügavamad kondrotsüüdid. Erineva sügavusega kõhrevöönditest eraldatud kondrotsüütide metabolismi teine oluline eristav omadus on reaktsioon eksogeensele stiimulile. M. Aydelotte jt sõnul olid kõhre pindmisest tsoonist pärit veise kondrotsüüdid IL-1 suhtes tundlikumad kui sügavast tsoonist pärit rakud.
Rakkude käitumine sõltub ka koe asukohast. Sama looma ribi- ja kõrvakõhre kondrotsüüdid reageerivad erinevalt kasvufaktoritele, nagu fibroblastide kasvufaktor (FGF) ja TGF-β. FGF suurendas tümidiini, proliini ja leutsiini inkorporeerimist kultiveeritud ribidesse, kuid mitte kõrva kondrotsüütidesse. TGF-β suurendas tümidiini inkorporeerimist ribi- ja kõrvakõhre kondrotsüütidesse, kuid ei mõjutanud tümidiini ja proliini inkorporeerimist kõrva kondrotsüütidesse. Suure koormusega piirkondadest pärinevad kõhrerakud erinevad kõhre madala koormusega piirkondadest pärinevatest rakkudest. Seega sünteesivad küpse lamba põlveliigese kõhre kondrotsüüdid sääreluu liigespinna keskpiirkonnast, mida ei kata menisk, millel on in vivo suurim koormus, vähem agrekaani, kuid rohkem dekoriini kui meniskiga kaetud tsoonide rakud. Autorid rõhutavad ka identsetest liigesetsoonidest pärinevate kõhrede kasutamise olulisust liigeste sünteetilise funktsiooni uurimisel.
Kondrotsüütide metabolism ja nende reaktsioon regulatiivsetele faktoritele sõltuvad oluliselt ka doonori vanusest, tema skeleti arengust ja liigeste seisundist, kust rakud on võetud. Inimese kondrotsüütides täheldatakse proliferatiivse reaktsiooni olulist vähenemist vanusega. Suurim langus on täheldatud 40–50-aastastel ja üle 60-aastastel doonoritel. Lisaks väheneb vananedes proliferatiivse reaktsiooni raskusaste kasvufaktoritele (nt FGF ja TGF-β). Lisaks kondrotsüütide proliferatsiooni kvantitatiivsetele muutustele esineb ka kvalitatiivseid muutusi. Noorte doonorite (10–20-aastased) rakud reageerivad trombotsüütidest pärinevale kasvufaktorile (PDGF) paremini kui TGF-β-le, samas kui täiskasvanud doonorite rakkudes on täheldatud vastupidist. Kondrotsüütide sünteetilise funktsiooni ja nende reaktsiooni kasvufaktoritele vanusest sõltuvate muutuste selgitamiseks kasutatakse mitmeid mehhanisme. Nende hulka kuuluvad pinnarakkude retseptorite arvu ja afiinsuse vähenemine, kasvufaktorite ja tsütokiinide sünteesi ja bioaktiivsuse muutused ning retseptorijärgsete signaalide muutumine.
Liigeste patoloogiline seisund muudab ka kondrotsüütide morfoloogiat ja metaboolset aktiivsust. Nii tuvastasid J. Kouri jt (1996) osteoartroosi korral kõhres kolm kondrotsüütide alampopulatsiooni. Kõhre keskosa pindmise ja ülemise osa kondrotsüüdid moodustavad klastreid ja sünteesivad suuremas koguses proteoglükaane ja kollageeni. TGF-beeta ja insuliinilaadne kasvufaktor (IGF) on võimelised stimuleerima kondrotsüütide poolt proteoglükaanide sünteesi ja osaliselt neutraliseerima IL-1 ja TNF-a toimet. Osteoartroosist kahjustatud kõhre eksplantaadid ja osteoartroosiga patsiendi kõhrest eraldatud kondrotsüüdid on TGF-beeta stimuleerimise suhtes tundlikumad kui terve kõhre kondrotsüüdid. Need erinevused on tõenäoliselt seotud liigesekõhre ülemiste kihtide kondrotsüütide fenotüüpiliste muutustega.
Individuaalsete kondrotsüütide eraldamine saavutatakse rakuvälise maatriksi (ECM) järjestikuse töötlemise teel proteolüütiliste ensüümidega. Pärast ECM-ist vabanemist sobivad eraldatud rakud ideaalselt maatriksikomponentide de novo sünteesi uurimiseks. Mõned autorid kasutavad ainult klostriidiaalset kollagenaasi, teised aga inkubeerivad kõhre eelnevalt trüpsiini, pronaasi, DNaasi ja/või hüaluronidaasiga. Isoleeritud rakkude arv sõltub kasutatavatest ensüümidest. Seega saab ainult kollagenaasiga töödeldes 1 g koest saada 1,4–106 kondrotsüüti, samas kui pronaasi, hüaluronidaasi ja kollagenaasi kasutamisel –4,3–106. Kollagenaasiga töödeldes jäävad agrekaan, valgud, IL-6 ja IL-8 rakukultuuri oluliselt suuremas koguses kui järjestikuse töötlemise korral erinevate ensüümidega. Nende kahe rakukultuuri erinevuste kohta on mitu selgitust:
- Rakuretseptorid kahjustuvad või inhibeerivad ensüümid, TGF-β inhibeerib DNA ja proteoglükaani sünteesi värskelt isoleeritud kondrotsüütides (1. päeval), samas kui monokihis kultiveeritud kondrotsüütides (7 päeva) stimuleerib TGF-β DNA ja proteoglükaani sünteesi. Enne katse algust on aga vaja piisavat perioodi nende membraanikomponentide taasekspressiooniks.
- Eksogeensed proteaasid võivad häirida integriini vahendatud raku ja maatriksi interaktsiooni. Integriinide perekond soodustab kondrotsüütide kinnitumist rakuvälise maatriksi molekulidele (Shakibaei M. jt, 1997). See häirimine võib mõjutada maatriksi geenide ekspressiooni.
- Maatrikskomponentide jäänused võivad reguleerida kondrotsüütide sünteetilist funktsiooni. Integriinid on võimelised ära tundma rakuvälise maatriksi (ECM) lagunemissaadusi, mängides seega olulist rolli kudede taastumisel pärast proteolüütiliste ensüümide toimet. T. Larsson jt (1989) teatasid, et tervete või fragmenteeritud proteoglükaanide lisamine rakukultuuri stimuleerib valkude ja proteoglükaanide sünteesi. Kõrge hüaluroonhappe tase põhjustab aga sulfaatide kaasamise olulist vähenemist proteoglükaanide sünteesis kanaembrüo kondrotsüütides, sea küpsetes kondrotsüütides ja roti kondrosarkoomi rakkudes. Lisaks on hüaluroonhape proteoglükaanide vabanemise inhibiitor rakkudest isegi IL-1b, TNF-a ja FGF juuresolekul, mis viitab kasvufaktorite ja tsütokiinide esimese bioloogilise aktiivsuse vastasele toimele. Hüaluroonhappe toime täpne mehhanism on endiselt ebaselge; on teada, et kondrotsüüdid sisaldavad tsütosooli aktiini filamentidega seotud hüaluroonhappe retseptorit. Hüaluroonhappe seondumine retseptoriga stimuleerib valkude fosforüülimist. Seega näitavad need andmed kondrotsüütide metaboolse funktsiooni moduleerimist maatriksvalkude fragmenteeritud või natiivsete molekulide poolt rakumembraani retseptorite aktiveerimise kaudu.
- Kondrotsüütide maatriksvalkude sünteesi kiire stimuleerimine ensüümide abil võib olla tingitud muutustest kondrotsüütide kujus ja/või tsütoskeleti reorganiseerumisest.
- Mõned tsütokiinid (nt IL-8) ja kasvufaktorid (nt IGF-1, TGF-β) sekvestreeritakse rakuvälise maatriksi (ECM) kihis. Tuntuim näide on TGF-β seondumine dekoriiniga, mille tagajärjel väheneb esimese võime indutseerida rakkude kasvu hiina hamstri munasarjarakkudes. Järeldus, et dekoriini sisaldus kõhres vanusega suureneb, viitab TGF-β biosaadavuse vähenemisele vananedes. Kasvufaktorid ja tsütokiinid võivad kultiveerimise ajal maatriksijääkidest vabaneda ja seejärel moduleerida kondrotsüütide funktsiooni.
Kondrotsüütide ühekihiline kultuur
Kondrotsüütide diferentseerunud fenotüüpi iseloomustab peamiselt II tüüpi kollageeni ja koespetsiifiliste proteoglükaanide süntees, samuti madal mitootilise aktiivsuse tase. On tõendeid, et pikaajalisel rakkude kultiveerimisel monokihis, samuti pärast mitut korduvat rakkude passaaži, kaotavad kondrotsüüdid oma sfäärilised kontuurid ja omandavad pikliku, fibroblastide sarnase kuju. Sellise fibroblastse metaplaasia korral muutub ka rakkude sünteetiline funktsioon, mida iseloomustab II, IX ja XI tüüpi kollageenide sünteesi progresseeruv vähenemine ning I, III ja Y tüüpi kollageenide sünteesi suurenemine. Funktsionaalse aggrekaani tõttu sünteesitakse väikesed mitteagregeerunud proteoglükaanid. Katepsiin B ja L süntees on diferentseerunud rakkudes äärmiselt madal, kuid diferentseerumise kadumise protsessis suureneb. Kollagenaas-1 ekspresseerub diferentseerunud kondrotsüütides; pikaajalise kultiveerimise korral selle ekspressioon väheneb, samal ajal kui metalloproteinaaside (TIMP-ide) kudede inhibiitorite tootmine suureneb.
Diferentseerunud kondrotsüüdid ekspresseerivad diferentseerunud fenotüübiga kollageeni uuesti, kui need viiakse monokihist suspensioonkultuuri. Diferentseerumisprotsess on tõenäoliselt seotud raku kujuga. Seda omadust kasutavad regulaarselt teadlased, kes uurivad defektseid transplantaate autoloogsete kondrotsüütidega. Väikest arvu biopsiamaterjalist saadud rakke saab monokihikultuuris laiendada ja seejärel enne siirdamist uuesti kolmemõõtmelisse maatriksisse viia. Spetsiifilise fenotüübi taasekspressiooni agaroosikultuuri üle kantud dediferentseeritud kondrotsüütides saab stimuleerida TGF-β, osseiini-hüdroksüapatiidi kompleksi ja askorbiinhappega.
Vastuseks kasvufaktoritele ja tsütokiinidele muutuvad kondrotsüüdid diferentseerumisprotsessi käigus. Rakuline vastus tsütokiinidele ja kasvufaktoritele erineb diferentseerumata ja diferentseerunud kondrotsüütide vahel. IL-1 stimuleerib fibroblastide proliferatsiooni, samas kui diferentseerumata kondrotsüütide kasvu pärsib IL-1. DNA sünteesi stimuleerib IGF-1 piklikes, kuid mitte lamenenud kondrotsüütides. Diferentseerunud kondrotsüütides on IL-1beta ja TNF-α stimuleeriv toime prokollagenaasi tootmisele tugevam kui diferentseerumata kondrotsüütides.
Kondrotsüütide kultiveerimine
Kondrotsüütide kultiveerimine suspensioonis vedelas keskkonnas või looduslikus või sünteetilises kolmemõõtmelises maatriksis stabiliseerib kondrotsüütide fenotüüpi. Rakud säilitavad oma sfäärilise kuju ja sünteesivad koespetsiifilisi valke. Kondrotsüütide suspensioonkultuuri soovitatakse tavaliselt uue peritsellulaarse maatriksi moodustumise uurimiseks. Kondrotsüütide kultuure sünteetilistes või looduslikes absorbeerivates polümeerides kasutatakse rakkude implanteerimiseks kõhredefektidesse, et stimuleerida liigese kõhrekoe regeneratsiooni. Implanteeritud rakkude sünteetiline või looduslik keskkond peab vastama mitmetele nõuetele:
- Rakkude adhesiooni ja kasvu tagamiseks peab implantaatidel olema poorne struktuur,
- ei polümeer ise ega selle lagunemissaadused tohiks in vivo implanteerimisel põhjustada põletikku ega toksilisi reaktsioone,
- transplantaadi kandjal peab olema võime seonduda külgneva kõhre või subhondraalse luuga,
- looduslikul või sünteetilisel maatriksi peab olema imendumisvõime, selle lagunemist peab tasakaalustama kudede regeneratsioon,
- Kõhre paranemise hõlbustamiseks peavad maatriksi keemiline struktuur ja pooride arhitektuur hõlbustama rakulise fenotüübi säilimist ja koespetsiifiliste valkude sünteesi selles paiknevate kondrotsüütide poolt,
- In vivo implanteerimise ajal on vaja uurida sünteetilise või loodusliku maatriksi mehaanilisi omadusi.
 [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Kondrotsüütide suspensioon vedelas faasis
Rakkude kinnitumist plastmahutitesse, milles kondrotsüüte kultiveeritakse, saab vältida, kattes nende seinad metüültselluloosi, agaroosi, hüdrogeeli (polü-2-hüdroksüetüülmetakrülaadi) või kollageen-agaroosi segu lahusega. Nendes tingimustes moodustavad kondrotsüüdid klastreid ja sünteesivad peamiselt aggrekaani ja koespetsiifilisi kollageene (II, IX, XI tüübid). Tavaliselt leidub kahte tüüpi rakke. Keskel asuvad rakud säilitavad sfäärilise kuju ja on ümbritsetud hästi arenenud rakuvälise kihiga (ECM), mida kinnitavad histokeemilised ja ultrastruktuurilised uuringud. Perifeerias on kondrotsüütidel diskoidsed kontuurid ja neid ümbritseb hõre ECM; selliste rakkude funktsionaalsete omaduste kohta on vähe teada.
Kondrotsüütide kultiveerimine mikrokandjatel, mida hoitakse suspensioonis, on võimalik; mikrokandjatena kasutatakse dekstraangraanuleid (cytodex), kollageeniga kaetud dekstraangraanuleid (cytodex III) ja I tüüpi kollageeni mittepoorseid mikrosfääre (cellagen). Nendes kultiveerimistingimustes kinnituvad kondrotsüüdid mikrokandja pinnale, säilitavad oma sfäärilise kuju ja moodustavad maatriksilaadse materjali. Lisaks soodustab cellageni kasutamine kondrotsüütide proliferatsiooni ja normaalse fenotüübi taasekspressiooni. Seetõttu saab kondrotsüütide kultiveerimist cellageni mikrosfääridel kasutada rakkude fenotüübi taastamiseks enne siirdamist.
Teine meetod kondrotsüütide suspensiooni kultiveerimiseks vedelas keskkonnas on nende kultiveerimine tihedate pallide kujul, mis koosnevad rakkudest (0,5-1 * 10 b ), mis saadakse tsentrifuugimise teel. Sellised kondrotsüüdid on võimelised tootma maatriksit, mis sisaldab suures koguses proteoglükaane, II tüüpi kollageeni, kuid mitte I tüüpi kollageeni, mida kinnitavad histoloogilised, immunohistokeemilised ja kvantitatiivsed meetodid.
Kondrotsüütide suspensioon looduslikus rakuvälise rakumembraanis (ECM)
Kondrotsüüte saab kultiveerida suspensioonis kolmemõõtmelises maatriksis (pehme agar, agaroos, kollageengeel või käsn, hüaluroonhape, fibriinliim, alginaatgraanulid).
Agaroosil kultiveeritud kondrotsüüdid säilitavad oma normaalse fenotüübi ja sünteesivad II tüüpi kollageeni ning koespetsiifilisi agrekaani agregaate. Agaroosil kultiveerimisel vabanevad raku poolt sünteesitud proteoglükaanid keskkonda 50 päeva jooksul. Võrdluseks, monokihi kultuuris on rakufaas glükosaminoglükaanidega üle täidetud juba esimese 5-6 kultiveerimispäeva jooksul; keskkonnas kultiveerimisel toimub pärast glükosaminoglükaanide suurenenud sünteesi ja vabanemist esimese 8-10 päeva jooksul nende ajast sõltuv vähenemine. Sellest hoolimata erineb kondrotsüütide käitumine agaroosil kultiveerimisel in vivo käitumisest. Agaroosil sisaldab suur hulk sünteesitud agrekaani agregaate väiksemaid molekule ja vähem molekule kui in vivo. TGF-β stimuleerib proteoglükaani sünteesi eksplantandis, kuid vähendab agrekaani sünteesi agaroosil.
Alginaat on lineaarne polüsahhariid, mida saadakse pruunvetikatest. Kahevalentsete katioonide, näiteks Ca2 + ioonide juuresolekul muutub see polümeer geeliks. Iga alginaati kinni jäänud kondrotsüüt on ümbritsetud negatiivselt laetud polüsahhariidide maatriksiga, mille poorid on võrreldavad hüaliinse kõhre omadega. Alginaathelmestes kondrotsüütide poolt moodustunud maatriks koosneb kahest sektsioonist - õhukesest rakkudega seotud maatriksi kihist, mis vastab liigesekõhre peritsellulaarsele ja territoriaalsele maatriksile, ning kaugemast maatriksist, mis on samaväärne natiivse koe interterritoriaalse maatriksiga. Kultiveerimise 30. päeval on rakkude ja iga kahe sektsiooni poolt hõivatud suhteline ja absoluutne maht alginaathelmestes peaaegu täielikult identne natiivse kõhre omaga. Peaaegu 30 päeva säilitavad kondrotsüüdid oma sfäärilise kuju ja toodavad aggrekaani, mille hüdrodünaamilised omadused on sarnased liigesekõhre maatriksi aggrekaani molekulide omadustega, samuti II, IX ja XI tüüpi kollageenimolekule. Samal ajal, nagu ka teistes suspensioonkultuurides, esinevad alginaathelmeste pinnal lamestatud rakud, mis toodavad väheses koguses I tüüpi kollageeni molekule, mis vabanevad otse keskkonda ja ei lülitu rakuvälise rakumembraani (ECM). Alginaathelmestes täheldatakse kondrotsüütide mõõdukat proliferatsiooni. Pärast 8-kuulist kultiveerimist alginaatgeelis ei kaota küpsed kondrotsüüdid metaboolset aktiivsust ja jätkavad koespetsiifilise II tüüpi kollageeni ja aggrekaani sünteesimist.
H. Tanaka jt (1984) uurisid erinevate looduslike molekulide difusiooniomadusi alginaadis ja leidsid, et üle 70 kDa molekulid ei difundeerunud läbi alginaadi. Seega sobib alginaadis rakukultuur maatriksi biosünteesi regulatsiooni ja rakuvälise maatriksi (ECM) organisatsiooni uurimiseks. Alginaadis kultiveeritud rakkude kättesaadavus võimaldab uurida peptiidregulatoorsete faktorite ja farmakoloogiliste ainete toimet transkriptsiooni, transkriptsioonijärgsel ja translatsioonilisel tasandil.
Kondrotsüüte kultiveeritakse ka I ja II tüüpi kollageenkiudude maatriksis. S. Nehrer jt (1997) võrdlesid koerte kondrotsüütide funktsiooni poorsetes kollageen-proteoglükaani polümeermaatriksites, mis sisaldavad erinevat tüüpi kollageene. Nad leidsid olulisi erinevusi I ja II tüüpi kollageeni sisaldavates kollageenmaatriksites kultiveeritud kondrotsüütide biosünteetilise funktsiooni morfoloogias. II tüüpi kollageeni maatriksi rakud säilitasid oma sfäärilise kuju, samas kui I tüüpi kollageenis oli neil fibroblastilaadne morfoloogia. Lisaks tootsid kondrotsüüdid II tüüpi kollageeni maatriksis suuremas koguses glükosaminoglükaane. J. van Susante jt (1995) võrdlesid alginaat- ja kollageengeelis (I tüüpi) kultiveeritud kondrotsüütide omadusi. Autorid leidsid kollageengeelis rakkude arvu olulise suurenemise, kuid alates 6. kultiveerimispäevast kaotasid rakud oma iseloomuliku fenotüübi, muutudes fibroblastilaadseteks rakkudeks. Alginaatgeelis täheldati rakkude arvu vähenemist, kuid kondrotsüüdid säilitasid oma normaalse fenotüübi. Kollageengeelis oli proteoglükaanide arv raku kohta oluliselt suurem kui alginaadis, kuid geelis täheldati maatrikselementide sünteesi vähenemist alates 6. kultiveerimispäevast, samas kui alginaadis süntees jätkas suurenemist.
Tahke kolmemõõtmeline fibriinmaatriks on looduslik aine, mis toetab selles diferentseerunud fenotüübiga suspendeeritud kondrotsüüte. Kolmemõõtmelist fibriinmaatriksit saab kasutada ka kandjana kondrotsüütide siirdamisel. Fibriini eelisteks on tsütotoksilisuse puudumine, võime täita ruumi ja adhesioonivõime. Histoloogilised ja biokeemilised uuringud, autoradiograafia ja elektronmikroskoopia on näidanud, et fibriingeelis olevad kondrotsüüdid säilitavad oma morfoloogia, prolifereeruvad ja toodavad maatriksit isegi pärast 2-nädalast kultiveerimist. G. Homminga jt (1993) teatasid aga, et fibriini lagunemine algab pärast 3-päevast kultiveerimist ja kondrotsüütide dedifferentseerumine jätkub.
Kondrotsüütide suspensioon kunstlikus (sünteetilises) rakuvälise rakumembraanis (ECM)
Rekonstruktiivseks või ortopeediliseks kirurgiaks mõeldud kõhreimplantaate saab saada isoleeritud kondrotsüütide in vitro kasvatamise teel sünteetilises bioühilduvas maatriksis.
Polüglükoolhappes kultiveeritud kondrotsüüdid prolifereeruvad ja säilitavad normaalse morfoloogia ja fenotüübi 8 nädala jooksul. Kondrotsüütide-polüglükoolhappe kompleks koosneb rakkudest, glükosaminoglükaanidest, kollageenidest ja sellel on väline kollageenkapsel. Sellised implantaadid sisaldavad aga kahte tüüpi kollageenimolekule - I ja II. Mitmete passaažide abil dediferentseeritud kondrotsüütidest pärinevatel implantaatidel on suurem glükosaminoglükaanide ja kollageenide kogus kui peamiselt diferentseerumata kondrotsüütidest pärinevatel implantaatidel.
L. Freed jt (1993b) võrdlesid inimese ja veise kondrotsüütide kultuuride käitumist kiulise polüglükoolhappe (FPGA) ja poorse polüpiimhappe (PPLA) keskkonnas. Pärast 6-8 nädalat kestnud veise kondrotsüütide kultiveerimist FPGA-s või PPLA-s täheldasid autorid rakkude proliferatsiooni ja kõhremaatriksi regeneratsiooni. FPGA-s olid kondrotsüüdid sfäärilise kujuga ja asusid kõhremaatriksiga ümbritsetud lakunades. Pärast 8-nädalast in vitro kultiveerimist sisaldas regenereeritud kude kuni 50% kuivainet (4% rakumassi, 15% glükosaminoglükaane ja 31% kollageene). PPLA-s olid rakkudel spindli kuju ning väike kogus glükosaminoglükaane ja kollageeni. FPGA-s oli rakkude kasv 2 korda intensiivsem kui PPLA-s. In vivo VPGK-s ja PPLC-s kasvatatud kondrotsüüdid tootsid 1-6 kuu jooksul kõhrega histoloogiliselt sarnast kude. Implantaadid sisaldasid glükosaminoglükaane, I ja II tüüpi kollageene.
Veise loote kondrotsüüte kultiveeriti poorses suure tihedusega hüdrofoobses ja hüdrofiilses polüetüleenis. Pärast 7-päevast inkubeerimist mõlemas substraadis säilitasid rakud sfäärilise kuju ja sisaldasid peamiselt II tüüpi kollageeni. Pärast 21-päevast kultiveerimist leiti, et hüdrofiilne maatriks sisaldas rohkem II tüüpi kollageeni kui hüdrofoobne maatriks.
Kõhrkude saab saada ka ühekihilise kultiveerimise teel Millicell-CM filtritel. Filtrite eelnev katmine kollageeniga on vajalik kondroitiinide kinnitumiseks. Kultuuri histoloogiline uuring näitab kondrotsüütide akumuleerumist rakuvälise kihi (ECM) sisse, mis sisaldab proteoglükaane ja II tüüpi kollageeni. I tüüpi kollageeni sellises kultuuris ei tuvastatud. Saadud kõhrkoe kondrotsüüdid on sfäärilise kujuga, kuid koe pinnal on nad mõnevõrra lamedad. Uue koe paksus suurenes aja jooksul ja sõltus rakkude monokihi algtihedusest. Optimaalsetes kultiveerimistingimustes ulatus kõhrkoe paksus 110 μm-ni, selle rakkude ja kollageeni organiseerumine pindmisteks ja sügavateks kihtideks on sarnane liigesekõhre omaga. ECM sisaldab ligikaudu 3 korda rohkem kollageeni ja proteoglükaane. Pärast 2-nädalast kultiveerimist täheldati maatriksi akumuleerumist, mis võimaldas koe filtrist eraldada ja siirdamiseks kasutada.
Sims jt (1996) uurisid kondrotsüütide kultiveerimist polüetüleenoksiidgeelis, mis on kapseldatud polümeermaatriks, mis võimaldab süstimise teel üle kanda suurt hulka rakke. Kuus nädalat pärast süstimist atüümsete hiirte nahaalusesse koesse moodustus uus kõhr, mida morfoloogiliselt iseloomustas valge opalestsents, mis sarnanes hüaliinse kõhrega. Histoloogilised ja biokeemilised andmed näitasid aktiivselt prolifereeruvate kondrotsüütide olemasolu, mis tootsid rakuvälise maatriksi (ECM).
Selgitus
Kõhrkoe eksplantatsiooni kasutatakse selles toimuvate ana- ja katabolismiprotsesside, homöostaasi säilitamise, resorptsiooni ja taastumise protsesside uurimiseks. Kõhrkoe eksplantaatides olevad kondrotsüüdid säilitavad normaalse fenotüübi ja rakuvälise maatriksi (ECM) koostise, mis on sarnane liigesekõhre omaga in vivo. Pärast 5-päevast kultiveerimist seerumi juuresolekul saavutatakse konstantne sünteesi tase ja loomulikud lagunemisprotsessid. Koeresorptsiooni saab kiirendada nii põhikultuuris kui ka kultuuris seerumi lisamisega, kasutades mitmeid aineid, näiteks IL-IB, TNF-α, bakteriaalsed lipopolüsahhariidid, retinoehappe derivaadid või aktiivsed hapnikuradikaalid. Kõhrkoe taastumise uurimiseks indutseeritakse selle kahjustus lahustuvate põletikumediaatorite (H2O2 ,IL -1, TNF- α ) või maatriksi füüsilise rebenemise abil.
Organotüübilise kultiveerimise meetod on mudel in vitro uuringuteks, mis uurivad isoleeritud välistegurite mõju kondrotsüütidele ja ümbritsevale maatriksile. In vivo paiknevad kondrotsüüdid rakuvälise maatriksi (ECM) sees hõredalt ega puutu üksteisega kokku. Liigesekõhre eksplantaadikultuur säilitab selle struktuurilise organisatsiooni, samuti spetsiifilised interaktsioonid kondrotsüütide ja ümbritseva rakuvälise keskkonna vahel. Seda mudelit kasutatakse ka mehaanilise stressi, farmakoloogiliste ainete, kasvufaktorite, tsütokiinide ja hormoonide mõju uurimiseks kõhre ainevahetusele.
Kõhrekoe eksplantatsiooni teine eelis on kondrotsüütide kahjustuste puudumine proteolüütiliste ensüümide või mehaaniliste tegurite toimel, mis on rakkude isoleerimisel vältimatu. Retseptorid ja teised membraanvalgud ning glükoproteiinid on kahjustavate tegurite eest kaitstud.
 [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
[ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
Chondroni kultuur
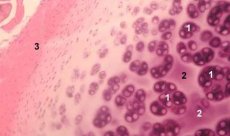
Kondron on liigesekõhre struktuurne, funktsionaalne ja metaboolne üksus, mis koosneb kondrotsüüdist, selle peritsellulaarsest maatriksist ja kompaktsest niitjast kapslist ning vastutab maatriksi homöostaasi eest. Kondronid eraldatakse kõhrest mehaaniliselt ja kogutakse mitme järjestikuse madala kiirusega homogeniseerimise abil. Erineva kõhre sügavusega tsoonidest eraldatud kondronid võib jagada nelja kategooriasse: üksikkondron, paarkondronid, mitmed (kolm või enam) lineaarselt paigutunud kondronid (kondronikolonnid) ja kondroniklastrid.
Üksikud kondrod esinevad tavaliselt terve kõhre keskmistes kihtides, paardunud kondrod leidub keskmise ja sügava kihi piiril, lineaarselt paigutunud mitmikkondronid on tüüpilised terve kõhre sügavatele kihtidele. Lõpuks koosnevad kondroniklastrid juhuslikult organiseeritud üksikute ja paardunud kondronite rühmadest, mis säilitavad pärast homogeniseerimist agregeeritud oleku. Kondroniklastrid on suured kõhrefragmendid, mis tavaliselt sisaldavad mitut kondronit ja radiaalselt paigutunud kollageenfibrille, st tüüpiline organisatsioon, mis on iseloomulik maatriksi sügavatele kihtidele. Kondronid on immobiliseeritud läbipaistvas agaroosis, mis võimaldab uurida nende struktuuri, molekulaarset koostist ja metaboolset aktiivsust. Kondroni-agaroosisüsteemi peetakse kõhre mikromudeliks, mis erineb traditsioonilisest kondrotsüütide-agaroosisüsteemist selle poolest, et säilib loomulik mikrokeskkond ning puudub vajadus seda sünteesida ja kokku panna. Kondronikultuur on mudel rakkude ja maatriksi interaktsioonide uurimiseks liigesekõhredes normaalsetes ja patoloogilistes tingimustes.
 [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Surematute kondrotsüütide kultuur
Rekombinantset DNA-d või onkogeeni sisaldavaid viiruseid, mis on võimelised muutma raku "surematuks", kasutatakse püsivate rakuliinide loomiseks. Surematutel kondrotsüütidel on võime lõputult prolifereeruda, säilitades samal ajal stabiilse fenotüübi. F. Mallein-Gerin jt (1995) näitasid, et SV40T onkogeen indutseerib hiire kondrotsüütide proliferatsiooni, mis jätkab stabiilselt II, IX ja XI tüüpi kollageeni, samuti liigese agrekaani ja siduva valgu ekspresseerimist. Selline rakuliin omandab aga võime sünteesida I tüüpi kollageeni, kui seda kasvatada monokihilises kultuuris või agaroosgeelis.
W. Horton jt (1988) kirjeldasid surematute rakkude liini, millel oli II tüüpi kollageeni mRNA madal ekspressioonitase. Need rakud saadi hiire retroviirusega transformeerimise teel, mis sisaldas I-myc- ja y-ra-onkogeene. Seda tüüpi rakud kujutavad endast ainulaadset mudelit liigesemaatriksi interaktsioonide uurimiseks II tüüpi kollageeni puudumisel, samuti II tüüpi kollageeni sünteesi regulatsiooni uurimiseks.
Muteerunud või kustutatud geenidega kondropriitide kultiveerimine on mugav mudel nende füsioloogilise funktsiooni uurimiseks. See mudel sobib eriti hästi spetsiifiliste molekulide rolli uurimiseks kõhremaatriksi organiseerimisel või erinevate regulatiivsete tegurite mõju uurimiseks kõhre ainevahetusele. IX tüüpi kollageeni kustutatud geeniga kondrotsüüdid sünteesivad normaalsest laiemaid kollageenifibrille, mis näitab, et IX tüüpi kollageen reguleerib fibrillide läbimõõtu. Nagu 1. peatükis märgitud, on hiljuti primaarse generaliseerunud osteoartriidiga perekondades avastatud II tüüpi kollageeni kodeeriva COLAI geeni mutatsioon. Mutantse II tüüpi kollageeni mõju uurimiseks liigesmaatriksile transfekteerisid R. Dharmrvaram jt (1997) in vitro inimese loote kondrotsüütidesse defektse COL2AI ( arginiin positsioonis 519 on asendatud tsüsteiiniga).
Kaaskultuurisüsteem. Liigeses interakteerub kõhr teist tüüpi rakkudega, mis asuvad sünoviaalmembraanis, sünoviaalvedelikus, sidemetes ja subhondraalses luus. Kondrotsüütide metabolismi võivad mõjutada mitmesugused lahustuvad faktorid, mida loetletud rakud sünteesivad. Seega artriidi korral hävitavad liigesekõhre sünoviaalrakkude poolt toodetud proteolüütilised ensüümid ja vabad radikaalid. Seetõttu on välja töötatud mudelid kõhre ja ümbritsevate kudede keeruliste interaktsioonide uurimiseks, mida nimetatakse kaaskultuurideks.
S. Lacombe-Gleise jt (1995) kultiveerisid küüliku kondrotsüüte ja osteoblaste kaaskultuurisüsteemis (COSTAR), kus rakud olid eraldatud mikropoorse membraaniga (0,4 μm), mis võimaldas kahe rakutüübi vahelist vahetust ilma otsese kontaktita. See uuring näitas osteoblastide võimet stimuleerida kondrotsüütide kasvu lahustuvate mediaatorite kaudu.
AM Malfait ja kaasautorid (1994) uurisid perifeerse vere monotsüütide ja kondrotsüütide vahelist seost. See mudel sobib tsütokiinide vahendatud protsesside uurimiseks põletikuliste artropaatiate (reumatoidartriit, seronegatiivsed spondüloartriidid jne) korral. Mudeli autorid eraldasid rakud valke siduva membraaniga, mille pooride läbimõõt oli 0,4 μm. Uuring näitas, et lipopolüsahhariidiga stimuleeritud monotsüüdid toodavad IL-1 ja TNF-α, mis pärssisid kondrotsüütide poolt agrekaani sünteesi ja aitasid kaasa juba sünteesitud agrekaani agregaatide lagunemisele.
K. Tada jt (1994) lõid kaaskultuuri mudeli, milles kollageeni (I tüüpi) geelis olevad endoteelirakud paigutati sisekambrisse, mis oli väliskambrist eraldatud filtri abil, mille pooride suurus oli 0,4 μm. Täielikus isolatsioonis väliskambrist moodustasid inimese endoteelirakud kollageenigeelis EGF-i või TGF-α juuresolekul torusid. Kui mõlemat tüüpi rakke kultiveeriti samaaegselt, siis TGF-α-st sõltuv torude moodustumine endoteelirakkude poolt pärsiti. Selle protsessi pärssimine kondrotsüütide poolt kõrvaldati osaliselt TGF-β-vastaste antikehadega. Võib eeldada, et kondrotsüütide poolt toodetud TGF-β pärsib kõhre enda vaskularisatsiooni.
S. Groot jt (1994) kultiveerisid samaaegselt 16-päevase hiireloote luu hüpertroofilistest ja proliferatiivsetest tsoonidest pärit kondrotsüüte koos ajukoe tükkidega. Pärast 4-päevast kultiveerimist täheldati kondrotsüütide transdiferentseerumist osteoblastideks ja osteoidide moodustumise algust. Pärast 11-päevast kultiveerimist oli osa kõhrest asendatud luukoega ja luumaatriks oli osaliselt kaltsifitseerunud. Mõned ajukoe poolt toodetavad neuropeptiidid ja neurotransmitterid mõjutavad osteoblastide metabolismi või omavad nende retseptoreid. Nende hulka kuuluvad norepinefriin, vasoaktiivne soolepeptiid, kaltsitoniini geeniga seotud peptiid, aine P ja somatostatiin. Kondrotsüütidega koos kultiveeritud ajukoe tükid võivad toota mõningaid loetletud faktoreid, mis on võimelised indutseerima kondrotsüütide transdiferentseerumise protsessi osteoblastideks.
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
Väliste tegurite mõju kondrotsüütide kultuurile
Hapniku pinge mõju kondrotsüütide metabolismile
Enamasti arenevad kondrotsüütide kultuurid atmosfääri hapnikurõhu tingimustes. Siiski on hästi teada, et in vivo kondrotsüüdid eksisteerivad hüpoksilistes tingimustes ja hapnikurõhu tase varieerub erinevates patoloogilistes tingimustes. Küpsemisprotsessi käigus täheldatakse olulisi muutusi epifüüside verevarustuses. Kuna vaskularisatsioon on kasvuplaadi erinevates tsoonides erinev, varieerub ka hapnikurõhu tase neis. C. Brighton ja R. Heppenstall (1971) näitasid, et küülikute sääreluuplaadis on hapnikurõhu tase hüpertroofilises tsoonis madalam kui ümbritsevas kõhres. Mõnede ainevahetusparameetrite mõõtmised näitasid, et kondrotsüüdid suudavad kiiresti reageerida hapniku kontsentratsiooni lokaalsetele muutustele. Esiteks, madala hapnikurõhu korral väheneb kondrotsüütide poolt selle tarbimine. Hapnikurõhu vähenemisega 21%-lt 0,04%-le suureneb glükoosi kasutamine, glükolüütiliste ensüümide aktiivsus ja piimhappe süntees. Isegi madala hapnikurõhu korral jääb ATP, ADP ja AMP absoluutkogus stabiilseks. Need andmed näitavad, et kondrotsüütide metabolism on suunatud maksimaalsele energiasäästule. Sünteetiline aktiivsus ja seega ka reparatsiooniprotsessid muutuvad aga hüpoksilistes tingimustes.
Kõrge hapnikurõhk mõjutab ka kondrotsüütide ainevahetust, põhjustades proteoglükaani ja DNA sünteesi vähenemist ning kõhremaatriksi lagunemist. Nende mõjudega kaasneb tavaliselt vabade hapnikuradikaalide teke.
Ioonkontsentratsiooni ja keskkonna osmootse rõhu mõju kondrotsüütide funktsioonile
Natiivses kõhres erineb ioonide kontsentratsioon oluliselt teiste kudede omast: naatriumisisaldus rakuvälises keskkonnas on 250–350 mmol ja selle osmolaarsus on 350–450 mosmooli. Kui kondrotsüüdid eraldatakse rakuvälisest meediumist (ECM) ja inkubeeritakse standardkeskkonnas (DMEM (Dulbecco minimaalne essentsiaalne sööde), osmolaarsus on 250–280,7 mosmooli), muutub rakkude ümbritsev keskkond dramaatiliselt. Lisaks on kaltsiumi ja kaaliumi kontsentratsioon standardkeskkonnas oluliselt madalam kui natiivses koes ning anioonide kontsentratsioon on oluliselt kõrgem.
Sahharoosi lisamine keskkonda suurendab selle osmolaarsust ja kutsub esile tsütosoolis H + ja kaltsiumioonioonide kontsentratsiooni mööduva rakusisese suurenemise. Sellised rakusisesed muutused võivad mõjutada kondrotsüütide diferentseerumisprotsesse ja nende metaboolset aktiivsust. J. Urban jt (1993) leidsid, et 358 -sulfaadi ja 3H -proliini omastamine isoleeritud kondrotsüütides, mida inkubeeriti standardses DMEM-is 2-4 tundi, oli vaid 10% natiivse koe omast. Sünteesi intensiivsus saavutas maksimumi rakuvälise keskkonna osmolaarsusel 350-400 mosmol nii värskelt isoleeritud kondrotsüütides kui ka kõhrekoe eksplantaatides. Lisaks suurenes kondrotsüütide maht 30-40% pärast isoleeritud rakkude paigutamist kindla osmolaarsusega standardsesse DMEM-i. Kondrotsüütide kultiveerimisel mittefüsioloogilise osmolaarsuse tingimustes 12-16 tunni jooksul kohanevad rakud uute tingimustega, vähendades biosünteesi intensiivsust proportsionaalselt rakuvälise keskkonna osmolaarsuse nihkega.
P. Borgetti jt (1995) uurisid rakuvälise keskkonna osmolaarsuse mõju sea kondrotsüütide kasvule, morfoloogiale ja biosünteesile. Autorid näitasid kondrotsüütide sarnaseid biokeemilisi ja morfoloogilisi omadusi, mida kultiveeriti söötmes osmolaarsusega 0,28 ja 0,38 mosmooli. Keskmise osmolaarsusega 0,48 mosmooli juures täheldati esimese 4-6 kultiveerimistunni jooksul rakkude proliferatsiooni ja valgusünteesi vähenemist, kuid need parameetrid taastusid hiljem ja saavutasid lõpuks kontrollväärtused. Kui kondrotsüüte kultiveeriti söötmes osmolaarsusega 0,58 mosmooli, kaotasid rakud võime säilitada proliferatiivsete protsesside füsioloogilist intensiivsust ja 6 päeva pärast vähenes kondrotsüütide arv oluliselt. Keskmise osmolaarsusega 0,58 mosmooli juures täheldati valgusünteesi olulist pärssimist. Lisaks säilitavad kondrotsüüdid osmolaarsusega 0,28-0,38 mOsm söötmes kultiveerimisel oma füsioloogilise fenotüübi; Suurema osmolaarsuse (0,48–0,58 mOsm) korral toimuvad rakkude morfoloogias olulised muutused, mis avalduvad iseloomuliku fenotüübi kadumises, kondrotsüütide muundumises fibroblastilaadseteks rakkudeks ja rakkude võime kadudes kokku panna maatriksproteoglükaane. Selle uuringu tulemused näitavad kondrotsüütide võimet reageerida rakuvälise keskkonna osmolaarsuse piiratud kõikumistele.
Ka teiste ioonide kontsentratsiooni muutused võivad mõjutada kondrotsüütide biosünteesi protsesse. Seega suureneb 35S (sulfaadi) inkorporeerimise aste poole võrra kaaliumiioonide kontsentratsiooni suurenemisega 5 mmol-lt (kontsentratsioon standardses DM EM söötmes) kuni 10 mmol-ni (kontsentratsioon ECM-is in vivo). Kaltsiumi kontsentratsioonid alla 0,5 mmol soodustasid kollageeni tootmist küpsetes veise kondrotsüütides, samas kui kontsentratsioon 1-2 mmol (vastab kontsentratsioonile standardses DM EM söötmes) põhjustas kollageeni sünteesi olulise vähenemise. Kõrge kaltsiumitaseme (2-10 mmol) korral täheldati biosünteesi mõõdukat suurenemist. Kondrotsüütide kinnitumisel ECM valkudele osalevad mitmesugused katioonid. Seega tagavad magneesiumi- ja mangaaniioonid kinnitumise fibronektiini ja II tüüpi kollageeniga, samas kui kaltsiumiioonid ei osale kondrotsüütide kinnitumisel valkudele. Seega näitavad kirjeldatud uuringute tulemused kaaliumi-, naatriumi- ja kaltsiumiioonide ning söötme osmolaarsuse muutuste mõju standardses söötmes inkubeeritud kondrotsüütide biosünteesi funktsioonile.
Mehaanilise stressi mõju kondrotsüütide metabolismile
Liigese immobiliseerimine põhjustab pöörduvat kõhre atroofiat, mis näitab mehaaniliste stiimulite vajadust normaalsete ainevahetusprotsesside jaoks rakuvälises maatriksis (ECM). Enamasti eksisteerivad kasutatavad rakukultuuri mudelid normaalse atmosfäärirõhu all. M. Wright jt (1996) näitasid, et mehaaniline keskkond mõjutab kondrotsüütide ainevahetust, raku reaktsioon sõltub survekoormuse intensiivsusest ja sagedusest. Katsed intaktse liigesekõhre eksplantaatide koormamisega in vitro näitasid valkude ja proteoglükaanide sünteesi vähenemist staatilise koormuse toimel, samas kui dünaamiline koormus stimuleerib neid protsesse. Mehaanilise koormuse täpsed mõjumehhanismid kõhrele on keerulised ja tõenäoliselt seotud rakkude deformatsiooni, hüdrostaatilise rõhu, osmootse rõhu, elektrilise potentsiaali ja maatriksmolekulide pinnarakkude retseptoritega. Iga parameetri mõju uurimiseks on vaja luua süsteem, kus ühte parameetrit saab sõltumatult varieerida. Näiteks ei sobi eksplantaadi kultuur rakkude deformatsiooni uurimiseks, kuid seda saab kasutada rõhu üldise mõju uurimiseks kondrotsüütide ainevahetusaktiivsusele. Kõhre kokkusurumine viib rakkude deformatsioonini ning sellega kaasneb ka hüdrostaatilise rõhugradiendi, elektrilise potentsiaali, vedeliku voolu teke ning muutused sellistes füüsikalis-keemilistes parameetrites nagu maatriksi veesisaldus, elektrilaengu tihedus ja osmootse rõhu tase. Rakkude deformatsiooni saab uurida agaroosi- või kollageengeeli kastetud isoleeritud kondrotsüütide abil.
Kondrotsüütide kultuuri mehaanilise stimulatsiooni mõju uurimiseks on välja töötatud mitu süsteemi. Mõned teadlased kasutavad süsteeme, kus rakukultuurile avaldatakse rõhku gaasilise faasi kaudu. Nii täheldasid JP Veldhuijzen jt (1979), kasutades atmosfäärirõhust 13 kPa kõrgemat rõhku madala sagedusega (0,3 Hz) 15 minuti jooksul, cAMP ja proteoglükaanide sünteesi suurenemist ning DNA sünteesi vähenemist. R. Smith jt (1996) näitasid, et veiste primaarsete kondrotsüütide kultuuri vahelduv kokkupuude hüdrostaatilise rõhuga (10 MPa) sagedusega 1 Hz 4 tunni jooksul põhjustas aggrekaani ja II tüüpi kollageeni sünteesi suurenemise, samas kui püsiv rõhk neid protsesse ei mõjutanud. Sarnast süsteemi kasutades teatasid Wright jt (1996), et tsükliline rõhk rakukultuurile on seotud kondrotsüütide rakumembraani hüperpolarisatsiooniga ja Ca2 + -sõltuvate kaaliumikanalite aktiveerimisega. Seega vahendavad tsüklilise rõhu mõju kondrotsüütide membraanis olevad venitusaktiveeritud ioonkanalid. Kondrotsüütide reaktsioon hüdrostaatilisele rõhule sõltub rakukultuuri tingimustest ja rakendatava koormuse sagedusest. Seega vähendab tsükliline hüdrostaatiline rõhk (5 MPa) sulfaatide liitumist kondrotsüütide monokihiga sagedustel 0,05, 0,25 ja 0,5 Hz, samas kui sagedusel üle 0,5 Hz sulfaatide liitumine kõhreeksplantaadiga suureneb.
M. Bushmann jt (1992) teatasid, et kondrotsüüdid agaroosgeelides muudavad biosünteesi vastusena staatilisele ja dünaamilisele mehaanilisele koormusele samamoodi nagu kultiveeritud terve organ. Autorid leidsid, et mehaaniline koormus tekitab hüperosmootse stiimuli, millele järgneb kondrotsüütide pH langus.
Mehaanilise venituse mõju saab uurida geeli sisse kastetud rakukultuuril. Venitusjõudu saab tekitada arvuti abil juhitava vaakumi abil. Kui süsteem on teatud vaakumiastme all, pikeneb Petri tassi põhi koos rakukultuuriga teadaoleva koguse võrra, deformatsioon on maksimaalne tassi põhja servades ja minimaalne keskel. Venitus kandub üle ka Petri tassis kultiveeritud kondrotsüütidele. Seda meetodit kasutades näitasid K. Holmvall jt (1995), et kollageeni (tüüp II) geelis kultiveeritud kondrosarkoomirakkudes suureneb α2-integriini mRNA ekspressioon . β2-integriin on võimeline seonduma II tüüpi kollageeniga. Seda peetakse mehaanoretseptoriks, kuna see interakteerub aktiini siduvate valkudega, ühendades seeläbi rakuvälise maatriksi (ECM) ja tsütoskeleti.
PH mõju kondrotsüütide metabolismile
Kõhrkoe rakuvälise maatriksi (ECM) interstitsiaalse vedeliku pH on happelisem kui teistes kudedes. A. Maroudas (1980) määras liigesekõhrmaatriksi pH väärtuseks 6,9. B. Diamant jt (1966) leidsid patoloogilistes tingimustes pH väärtuseks 5,5. On teada, et kondrotsüüdid elavad madala PO2 taseme juures, mis näitab glükolüüsi (95% kogu glükoosi metabolismist) olulist rolli nende rakkude metabolismis; glükolüüsiga kaasneb suures koguses piimhappe tootmine.
Lisaks keskkonna hapestumisele glükolüüsi produktide poolt on maatriksi komponendid ise väga olulised. Proteoglükaanide suur fikseeritud negatiivse laengu hulk muudab rakuvälist ioonkoostist: täheldatakse vabade katioonide (nt H +, Na +, K + ) suurt kontsentratsiooni ja anioonide (nt O2, HCO3) väikest kontsentratsiooni. Lisaks eemaldatakse mehaanilise koormuse mõjul rakuvälisest meediumist (ECM) vesi, mis viib fikseeritud negatiivsete laengute kontsentratsiooni suurenemiseni ja suurema hulga katioonide ligitõmbamiseni maatriksisse. Sellega kaasneb rakuvälise keskkonna pH langus, mis mõjutab rakusisest pH-d, muutes seeläbi kondrotsüütide metabolismi. R. Wilkin ja A. Hall (1995) uurisid rakuvälise ja rakusisese keskkonna pH mõju maatriksi biosünteesile isoleeritud veiste kondrotsüütides. Nad täheldasid maatriksi sünteesi kahekordset modifikatsiooni pH langusega. pH kerge langus (7,4 < pH < 7,1) 50% võrra suurendas 35SO4 ja 3H-proliini lisandumist kondrotsüütidesse, samaskui keskkonna sügavam hapestamine (pH < 7,1) pärssis sünteesi 75% võrreldes kontrollrühmaga. Madala pH (6,65) loomine ammooniumiioonide abil põhjustas maatriksi sünteesi vähenemise vaid 20%. Saadud tulemused näitavad, et maatriksi sünteesi rakuvälise keskkonna pH muutumist ei saa seletada ainult rakusisese keskkonna pH muutustega. Lisaks on kondrotsüütidel võime reguleerida rakusisest pH-d Na +, H + -vaheti, Ka + -sõltuva Cl_ - НСОС3-transporteri ja H + /ATPaasi abil.
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ]
Kultuurikeskkonna koostise mõju kondrotsüütide metabolismile
Kondrotsüütide kultiveerimiskeskkond peab vastama katsetingimustele. Viimastel aastatel on kultiveerimistingimuste optimeerimiseks kasutatud vasika seerumit. Seerumi kasutamisel tuleb aga arvesse võtta mitmeid olulisi punkte:
- rakkude väljapoole kasvamine koe perifeeriast elundikultuurides,
- erinevate seeriate seerumite koostise varieeruvus,
- tundmatute komponentide olemasolu neis,
- suurenenud interferentsi ja artefaktide oht erinevate bioloogiliste tegurite mõju uurimisel rakkude metaboolsele aktiivsusele.
Viimase näiteks on uuring EGF-i mõjust kõhrekondrotsüütidele rottidel. EGF stimuleeris 3H -tümidiini inkorporeerumist ja DNA sisalduse suurenemist kultuuris. See efekt oli märgatavam madalate seerumikontsentratsioonide (<1%) korral, kuid kõrgete kontsentratsioonide (>7,5%) korral efekt kadus.
On hästi teada, et vasikaseerumiga rikastatud DMEM-is on sünteesi ja lagunemise tasemed oluliselt suurenenud võrreldes in vivo tingimustega. Erinevused in vivo ja in vitro metabolismi vahel võivad tuleneda erinevustest sünoviaalvedeliku ja keskkonna vahel, milles rakke kultiveeritakse. Lee jt (1997) kultiveerisid noori veise kondrotsüüte agaroosis, kasutades toitainekeskkonda, mis sisaldas DMEM-i, millele oli lisatud 20% vasikaseerumit ja suures koguses normaalset allogeenset sünoviaalvedelikku. Sünoviaalvedeliku olemasolu keskkonnas indutseeris proteoglükaanide hulga suurenemise kuni 80%-ni sünoviaalvedeliku koguhulgast. Need tulemused näitavad, et sünoviaalvedelik kultuuris indutseerib sarnase metabolismi taseme nagu in vivo, glükosaminoglükaanide sünteesi kõrge taseme ja rakkude jagunemise madala tasemega.
G. Verbruggen jt (1995) näitasid, et 35S -arrpeKaHa süntees inimese kondrotsüütides, mida kultiveeriti agaroosil seerumivabas DMEM-is, oli 20–30% sünteesi tasemest, mida täheldati 10% vasika seerumiga rikastatud DMEM-is. Autorid määrasid, mil määral taastasid IGF-1, IGF-2, TGF-R või insuliin aggrekaani tootmise seerumivabas söötmes. Autorid jõudsid järeldusele, et 100 ng/ml insuliini, IGF-1 või IGF-2 taastas osaliselt aggrekaani sünteesi 39–53%-ni kontrolltasemest. Loetletud tegurite kombinatsiooni korral ei täheldatud sünergismi ega kumulatsiooni. Samal ajal stimuleeris 10 ng/ml TGF-R 100 ng/ml insuliini juuresolekul aggrekaani sünteesi 90%-ni või rohkemani kontrolltasemest. Lõpuks ei mõjutanud inimese seerumi transferriin, üksi või kombinatsioonis insuliiniga, aggrekaani sünteesi. Kui vasikaseerum asendati veise seerumi albumiiniga, vähenes agrekaani agregaatide sisaldus märkimisväärselt. Kultiveerimiskeskkonna rikastamine insuliini, IGF-i või TGF-R-ga taastas osaliselt rakkude võime toota agrekaani agregaate. Lisaks on IGF-1 ja insuliin võimelised säilitama rakukultuurides homöostaasi. Pärast 40-päevast kultiveerimist 10-20 ng/ml IGF-1-ga rikastatud keskkonnas püsis proteoglükaani süntees samal tasemel või isegi kõrgemal võrreldes 20% vasikaseerumit sisaldava keskkonnaga. Kataboolsed protsessid kulgesid IGF-1-ga rikastatud keskkonnas aeglasemalt kui 0,1% albumiini lahusega rikastatud keskkonnas, kuid mõnevõrra kiiremini 20% seerumiga rikastatud keskkonnas. Pikaealistes kultuurides hoiab 20 ng/ml IGF-1 rakkude stabiilset seisundit.
D. Lee jt (1993) võrdlesid kultuurikeskkonna koostise (DMEM, DMEM+20% vasikaseerum, DMEM+20 ng/ml IGF-1) mõju DNA sünteesile kõhrekoe eksplantaadikultuuris, monokihikultuuris ja agaroosisuspensioonis. Agaroosil seerumi juuresolekul kultiveerimisel täheldasid autorid kondrotsüütide kalduvust grupeeruda suurteks klastriteks. Seerumita või IGF-1-ga kultiveeritud rakud säilitasid agaroosis ümara kuju, kogunesid väikesteks rühmadeks, kuid ei moodustanud suuri agregaate. Monokihis oli DNA süntees seerumit sisaldavas keskkonnas oluliselt kõrgem kui IGF-1-ga rikastatud keskkonnas; viimases oli DNA süntees oluliselt kõrgem kui rikastamata keskkonnas. Kondrotsüütide kultiveerimisel agaroosisuspensioonis rikastamata keskkonnas ja IGF-1-ga keskkonnas ei leitud DNA sünteesis erinevusi. Samal ajal kaasnes kondrotsüütide suspensioonide kultiveerimine agaroosis seerumiga rikastatud söötmes radionukleotiidi 3H -tümidiini suurenenud inkorporeerumisega võrreldes teiste söötmetega.
C-vitamiin on vajalik ensüümide aktiveerimiseks, mis osalevad kollageenifibrillide stabiilse spiraalse struktuuri moodustumisel. Askorbiinhappe puudusega kondrotsüüdid sünteesivad alahüdroksüülitud mitte-heeliksilisi kollageeni eellasühendeid, mis sekreteeritakse aeglaselt. Askorbiinhappe (50 μg/ml) manustamine põhjustab II ja IX tüüpi kollageeni hüdroksüülimist ja nende sekretsiooni normaalses koguses. C-vitamiini lisamine ei mõjutanud proteoglükaani sünteesi taset. Seega reguleeritakse kollageeni sekretsiooni proteoglükaani sekretsioonist sõltumatult.

