Artikli meditsiiniline ekspert
Uued väljaanded
Osteoartriit: meniskektoomia mõju liigesekõhnele
Viimati vaadatud: 04.07.2025

Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
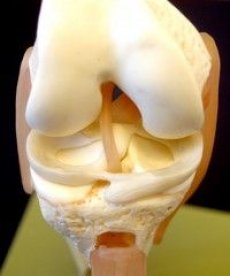
Nagu varem mainitud, mängivad liigesmeniskid olulist rolli liigese normaalses funktsioonis. Meniskid on struktuurid, mis suurendavad reieluu ja sääreluu liigespindade kongruentsust, parandavad külgmist stabiilsust ning parandavad sünoviaalvedeliku jaotumist ja toitainete vahetust liigesekõhrega. Täielik või osaline meniskektoomia viib sääreluu liigespinna koormuse suuna muutumiseni, mille tulemuseks on liigesekõhre degeneratsioon.
Paljud uuringud on pühendatud meniskektoomia mõju uurimisele liigese biomehaanikale, samuti degeneratiivsete protsesside esilekutsumisele liigesekõhre ja subhondraalse luu puhul loomadel (tavaliselt koertel ja lammastel). Algselt tegid teadlased põlveliigese mediaalse meniski ektoomia, kuid hiljem leiti, et lateraalse meniski ektoomia viib osteoartriidi kiirema arenguni.
Little jt (1997) uurisid lammastel lateraalse meniskektoomia abil liigesekõhre ja subhondraalse luu muutusi mitmes põlveliigese piirkonnas. Tüüpilised histoloogilised leiud, mis illustreerivad 6 kuud pärast operatsiooni indutseeritud muutusi liigesekõhre, olid kõhre narmendamine, proteoglükaani kontsentratsiooni vähenemine ja kondrotsüütide arvu vähenemine. Subhondraalse luu muutunud kõhre piirkondade all täheldati kapillaaride kasvu kaltsifitseeritud kõhre tsooni, "lainelise ääre" väljapoole nihkumist ja subhondraalse luu käsnja aine paksenemist.
P. Ghosh jt (1998) uuringus näidati, et lammastel 9 kuud pärast lateraalset meniskektoomiat ilmnevad subhondraalse luu ümberehituse tunnused ja luu mineraalse tiheduse suurenemine, mis on tingitud liigesekõhre degeneratsioonist. Tsoonides, mis on lateraalse meniski eemaldamise tõttu allutatud ebanormaalselt suurele mehaanilisele koormusele (reieluu lateraalne kondüül ja sääreluu lateraalne plaat), leiti dermatansulfaati sisaldavate proteoglükaanide suurenenud süntees, kuigi sama tüüpi proteoglükaanide suurenenud sünteesi leiti ka mediaalse plaadi kõhres. Selgus, et dermatansulfaati sisaldavaid proteoglükaane esindab peamiselt dekoriin. Selle kõrgeim kontsentratsioon leiti liigesekõhre keskmises ja sügavas tsoonis.
Koos dermataansulfaati sisaldavate proteoglükaanide sünteesi suurenemisega kõhre piirkondades, mis kannavad külgmise meniski eemaldamise tõttu suurt koormust, tuvastati aggrekaani suurenenud katabolism, mida näitab selle fragmentide vabanemine kõhreeksplantaatidest toitainekeskkonda, samuti MMP ja aggrekanaaside kõrge aktiivsus. Kuna põletikuline aktiivsus selles osteoartroosi mudelis oli minimaalne, pakkusid autorid välja, et ensüümide allikaks olid kondrotsüüdid.
Kuigi palju vastuseta küsimusi on endiselt, näitavad ülalkirjeldatud uuringud biomehaaniliste tegurite võimalikku rolli osteoartriidi patogeneesis. On selge, et kondrotsüüdid on võimelised "tundma" oma keskkonna mehaanilisi omadusi, reageerides muutustele, sünteesides rakuvälise maatriksi (ECM), mis talub suuremaid koormusi ja seega ennetab kõhrekahjustusi. Noortel loomadel indutseeris mõõdukas füüsiline koormus aggrekaanirikka ECM-i sünteesi. See kondrotsüütide vastuse hüpertroofiline (või adaptiivne) faas võib kesta mitu aastat, pakkudes liigesekõhrele stabiilset mehaanilist koormust. Selle tasakaalu häirimine koormuse intensiivsuse või kestuse suurenemise või normaalse liigese biomehaanika muutuste tõttu pärast vigastust või operatsiooni või kondrotsüütide võime vähenemise tõttu suurendada ECM-i sünteesi vastusena suurenenud koormusele (vananemise ajal) toob endokriinsete tegurite toime kaasa olulisi muutusi raku- ja maatriksitasandil: proteoglükaanide ja II tüüpi kollageeni süntees on pärsitud ning dekoriini ja I, III ja X tüüpi kollageeni süntees on stimuleeritud. Samaaegselt biosünteesi muutusega suureneb ECM-i katabolism, samuti MMP-de ja aggrekanaaside tase. Ei ole teada, kuidas mehaaniline koormus soodustab ümbritseva rakuvälise membraanmembraani (ECM) resorptsiooni kondrotsüütide poolt; seda protsessi vahendavad tõenäoliselt prostanoidid, tsütokiinid (näiteks IL-1p või TNF-α) ja vabad hapnikuradikaalid. Siinkohal on vaja mainida sünoviidi rolli osteoartriidi puhul, kuna ülalmainitud katabolismi mediaatorite kõige tõenäolisem allikas võivad olla makrofaagitaolised sünovotsüüdid ja leukotsüüdid, mis infiltreeruvad liigese sünoviaalmembraani.
OD Chrismani jt (1981) uuring näitas, et traumaatiline liigesevigastus stimuleerib prostaglandiini eelkäija arahhidoonhappe tootmist. Kahjustatud kondrotsüütide membraane peetakse arahhidoonhappe allikaks. On hästi teada, et arahhidoonhape muundatakse ensüümi tsüklooksügenaasi (COX) abil kiiresti prostaglandiinideks. On tõestatud, et prostaglandiinid, eriti PGE2 , interakteeruvad kondrotsüütide retseptoritega, muutes nende geenide ekspressiooni. Siiski jääb ebaselgeks, kas arahhidoonhape stimuleerib või pärsib proteinaaside ja agrekanaaside tootmist. Varasemad uuringud on näidanud, et PGE2 suurendab MMP tootmist ja põhjustab liigesekõhre lagunemist. Teiste uuringute tulemuste kohaselt on PGE2 -l anaboolne toime rakuvälisele maatriksile (ECM) ja see soodustab ka ECM-i terviklikkust, pärssides kondrotsüütide tsütokiinide tootmist. On võimalik, et nende uuringute vastuolulised tulemused tulenevad neis kasutatud PGE2 erinevatest kontsentratsioonidest.
Liigesekõhre kahjustusele reageerides võib tekkida väike kogus IL-1β-d (peamine tsütokiin, mis stimuleerib MMP-de sünteesi ja vabanemist ning pärsib nende looduslike inhibiitorite aktiivsust), mis viib kudede edasise lagunemiseni.
Seega on selles osas kirjeldatud uuringud näidanud, et liigesele alla läve avaldatava dünaamilise koormuse säilitamine põhjustab uute mehaaniliste tingimuste talumiseks võimeliste kondrotsüütide proliferatsiooni, mis tähendab osteoartroosi hüpertroofilise staadiumi algust. Hüpertrofeerunud kondrotsüüdid on diferentseerumise viimases staadiumis olevad rakud, mis tähendab, et peamiste maatriksielementide geenide ekspressioon neis on muutunud. Seetõttu on agrekaani proteoglükaanide ja II tüüpi kollageeni süntees pärsitud ning dekoriini, I, III ja X tüüpi kollageenide süntees suureneb.
Agrekaani ja II tüüpi kollageeni sisalduse vähenemine rakuvälise meediumi (ECM) koostises, mis on seotud sünteesi- ja lagunemisprotsesside tasakaalustamatusega, annab liigesekõhrele omaduse mittepiisavalt reageerida mehaanilisele stressile. Selle tulemusena muutuvad kondrotsüüdid kaitsmata ja protsess liigub kolmandasse, kataboolsesse staadiumisse, mida iseloomustab liigne proteolüütiline aktiivsus ning autokriinsete ja parakriinsete regulatiivsete faktorite sekretsioon. Morfoloogiliselt iseloomustab seda staadiumi liigesekõhre ECM-i hävimine; kliiniliselt vastab see manifestsele osteoartroosile. See hüpotees esindab muidugi lihtsustatud nägemust kõigist osteoartroosi korral toimuvatest keerukatest protsessidest, kuid üldistab osteoartroosi patobioloogia tänapäevast kontseptsiooni.
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]

