Artikli meditsiiniline ekspert
Uued väljaanded
Raske sepsise ja septilise šoki ravi
Viimati vaadatud: 04.07.2025

Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
Sepsise efektiivne ravi on võimalik ainult infektsioonikoha täieliku kirurgilise sanitaartehnilise puhastamise ja piisava antimikroobse ravi korral. Ebapiisav esialgne antimikroobne ravi on sepsisega patsientide surma riskitegur. Patsiendi elu säilitamine, elundite talitlushäirete ennetamine ja kõrvaldamine on võimalik ainult sihipärase intensiivravi abil.
Selle peamine eesmärk on optimeerida O2 transporti suurenenud tarbimise tingimustes, mis on tüüpiline raske sepsise ja septilise šoki korral. Seda ravi rakendatakse hemodünaamika ja hingamise toetamise kaudu.
Hemodünaamiline tugi
Infusioonravi
Infusioonravi on üks esimesi meetmeid hemodünaamika ja eelkõige südame väljundi säilitamiseks. Selle peamised ülesanded sepsisega patsientidel on:
- piisava koeperfusiooni taastamine,
- homöostaasi häirete korrigeerimine,
- rakkude ainevahetuse normaliseerimine,
- septilise kaskaadi mediaatorite ja toksiliste metaboliitide kontsentratsiooni vähenemine.
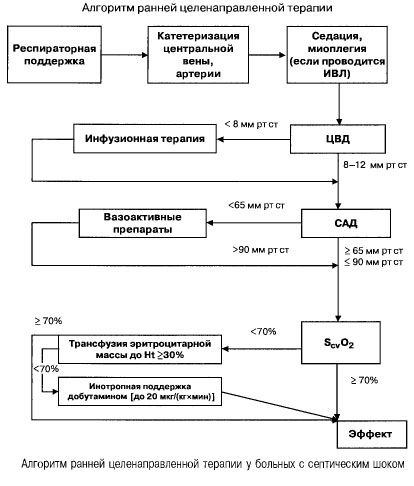
Mitme organi puudulikkuse ja septilise šoki korral sepsise korral püüavad nad kiiresti (esimese 6 tunni jooksul) saavutada järgmiste oluliste näitajate väärtused:
- hematokrit >30%,
- diurees 0,5 ml/(kg/h),
- vere küllastus ülemises õõnesveenis või paremas kojaosas >70%,
- keskmine vererõhk >65 mm Hg,
- Südame vaskulaarne rõhk 8–12 mm Hg
Nende väärtuste hoidmine kindlaksmääratud tasemel parandab patsientide elulemust (tõendite kategooria B). Hemodünaamiline jälgimine Swan-Ganzi kateetri ja PICCO-tehnoloogia (transpulmonaalne termodilutsioon ja pulsilaine analüüs) abil laiendab hemodünaamilise ravi jälgimise ja efektiivsuse hindamise võimalusi, kuid puuduvad tõendid selle kohta, et need parandaksid elulemust.
Optimaalne eelkoormuse väärtus valitakse individuaalselt, kuna on vaja arvestada endoteeli kahjustuse astet ja kopsude lümfiringe seisundit, vatsakeste diastoolset funktsiooni ja intratorakaalse rõhu muutusi. Infusioonravi maht valitakse nii, et PCWP ei ületaks plasma COP-i (OL-i ennetamine) ja CO suureneks. Lisaks võetakse arvesse kopsude gaasivahetusfunktsiooni iseloomustavaid parameetreid (paO2 ja paO2 / FiO2 ) ja radiograafilise pildi muutusi.
Sepsise ja septilise šoki sihipärase ravi osana infusioonravi puhul kasutatakse kristalloid- ja kolloidlahuseid praktiliselt identsete tulemustega.
Kõigil infusioonikeskkondadel on nii eeliseid kui ka puudusi. Tänapäeval, arvestades eksperimentaalsete ja kliiniliste uuringute tulemusi, pole põhjust eelistada ühtegi konkreetset tüüpi.
- Näiteks venoosse tagasivoolu ja eelkoormuse taseme piisavaks korrigeerimiseks on vaja manustada kristalloidide mahtu, mis on 2-4 korda suurem kui kolloididel, mis on seotud lahuse jaotumise iseärasustega organismis. Lisaks on kristalloidide infusioon seotud suurema koeödeemi riskiga ja nende hemodünaamiline toime on lühem kui kolloididel. Samal ajal on kristalloidid odavamad, ei mõjuta hüübimispotentsiaali ega kutsu esile anafülaktoidseid reaktsioone. Eelneva põhjal määratakse infusiooniprogrammi kvalitatiivne koostis sõltuvalt patsiendi iseärasustest, võttes arvesse hüpovoleemia astet, DIC-sündroomi faasi, perifeerse turse esinemist ja albumiini kontsentratsiooni vereseerumis, ägeda kopsukahjustuse raskusastet.
- Raske basaalrakkude kartsinoomi puudulikkuse korral on näidustatud plasmaasendajad (dekstraanid, želatiinipreparaadid, hüdroksüetüültärklis). Hüdroksüetüültärklistel, mille asendusaste on 200/0,5, 130/0,4 ja 130/0,42, on dekstraanide ees potentsiaalne eelis tänu väiksemale membraanist väljapääsu riskile ja kliiniliselt olulise mõju puudumisele hemostaasile.
- Albumiini manustamine kriitilistes tingimustes võib suurendada surmaohtu. COP-i tõus infusiooni ajal on mööduv ja seejärel, kapillaaride suurenenud läbilaskvuse tingimustes ("kapillaaride lekke" sündroom), toimub albumiini edasine ekstravasatsioon. On võimalik, et albumiini ülekanne on kasulik ainult siis, kui selle kontsentratsioon seerumis on alla 20 g/l ja interstitsiumisse "lekke" märke ei esine.
- Krüoplasma kasutamine on näidustatud tarbimiskoagulopaatia ja vere hüübimispotentsiaali vähenemise korral.
- Doonori punaste vereliblede massi laialdast kasutamist tuleks piirata mitmesuguste tüsistuste (APL, anafülaktilised reaktsioonid jne) tekke suure riski tõttu. Enamiku ekspertide sõnul on raske sepsisega patsientidel minimaalne hemoglobiini kontsentratsioon 90-100 g/l.
Hüpotensiooni korrigeerimine
Madal perfusioonirõhk nõuab kohest ravimite aktiveerimist, mis suurendavad veresoonte toonust ja/või südame inotroopset funktsiooni. Dopamiin või norepinefriin on esmavaliku ravimid hüpotensiooni korrigeerimiseks septilise šokiga patsientidel.
Dopamiin (dopmiin) annuses <10 mcg/(kg x min) tõstab vererõhku, peamiselt CO suurendamise kaudu, ja avaldab süsteemsele vaskulaarsele resistentsusele minimaalset mõju. Suurte annuste korral domineerib selle α-adrenergiline toime, mis viib arteriaalse vasokonstriktsioonini, ja annuses <5 mcg/(kg x min) stimuleerib dopamiin neeru-, mesenteeriumi- ja koronaarveresoonte dopamiinergilisi retseptoreid, mis viib vasodilatatsioonini, glomerulaarfiltratsiooni suurenemiseni ja Na+ eritumiseni.
Noradrenaliin suurendab keskmist arteriaalset rõhku ja suurendab glomerulaarfiltratsiooni. Süsteemse hemodünaamika optimeerimine selle toimel viib neerufunktsiooni paranemiseni ilma dopamiini väikeste annuste kasutamiseta. Viimaste aastate uuringud on näidanud, et selle isoleeritud kasutamine võrreldes suurte dopamiiniannustega kombinatsioonis viib statistiliselt olulise suremuse vähenemiseni.
Adrenaliin on adrenergiline ravim, millel on kõige väljendunud hemodünaamilised kõrvaltoimed. Sellel on annusest sõltuv mõju südame löögisagedusele, keskmisele arteriaalsele rõhule, südame väljundmahule, vasaku vatsakese funktsioonile ning O2 kohaletoimetamisele ja tarbimisele . Tahhüarütmiad, elundite verevoolu halvenemine ja hüperlaktateemia esinevad aga samaaegselt. Seetõttu piirdub adrenaliini kasutamine juhtudega, kus teised katehhoolamiinid ei ole täielikult ravitavad.
Dobutamiin on eelistatud ravim CO ja O2 kohaletoimetamise ja tarbimise suurendamiseks normaalse või kõrgenenud eelkoormuse korral. Tänu oma valdavale toimele beeta1-adrenergilistele retseptoritele on see nende parameetrite suurendamisel efektiivsem kui dopamiin.
Eksperimentaalsed uuringud on näidanud, et katehhoolamiinid suudavad lisaks vereringe toetamisele reguleerida süsteemse põletiku kulgu, mõjutades võtmemediaatorite sünteesi kaugmõjuga. Adrenaliini, dopamiini, noradrenaliini ja dobutamiini mõjul vähendavad aktiveeritud makrofaagid TNF-α sünteesi ja sekretsiooni.
Adrenergiliste ainete valik toimub vastavalt järgmisele algoritmile:
- südameindeks 3,5–4 l/(min x m² ), SvO² > 70% – dopamiin või norepinefriin,
- südameindeks <3,5 l/(min x m2 ), SvO2 < 70% - dobutamiin (kui süstoolne vererõhk <70 mm Hg - koos norepinefriini või dopamiiniga).
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
Hingamisteede tugi
Kopsud on sepsise patoloogilises protsessis esimeste sihtorganite seas. Äge hingamispuudulikkus on üks peamisi mitme organi düsfunktsiooni komponente. Selle kliinilised ja laboratoorsed ilmingud sepsise korral vastavad ALI-le ja patoloogilise protsessi progresseerumisel ARDS-ile. Mehaanilise ventilatsiooni näidustused raske sepsise korral määratakse sõltuvalt parenhümatoosse hingamispuudulikkuse (ARF või ARDS) raskusastmest. Selle kriteeriumiks on hingamisindeks:
- <200 - on näidustatud trahhea intubatsioon ja hingamisabi,
- >200 – näidud määratakse individuaalselt.
Kui patsient on hapnikutoega spontaanse hingamise ajal teadvusel, hingamistööle ei tehta suuri kulutusi ja esineb väljendunud tahhükardiat (pulsisagedus <120 minutis), venoosse tagasivoolu SO2 normaalväärtus on > 90%, siis on võimalik hoiduda tema üleviimisest kunstlikule ventilatsioonile. Siiski on vaja patsiendi seisundit hoolikalt jälgida. SO2 optimaalne väärtus on umbes 90%. Seda saab säilitada erinevate gaasimanustamise meetoditega (näomaskid, ninakateetrid) mittetoksilistes kontsentratsioonides (FiO2 < 0,6). Mitteinvasiivne kunstlik ventilatsioon on sepsise korral vastunäidustatud (tõendite kategooria B).
Vältida tuleks suuremahulisi mehaanilise ventilatsiooni (MVV) režiime (VO2 = 12 ml/kg), kuna sellistel juhtudel suureneb tsütokiinide sekretsioon kopsude poolt, mis süvendab MOF-i. Vajalik on järgida ohutu mehaanilise ventilatsiooni kontseptsiooni, mis on võimalik järgmiste tingimuste täitmisel (tõendite kategooria A):
- DO <10 ml/kg,
- sissehingamise ja väljahingamise mittepöördvõrdeline suhe,
- maksimaalne hingamisteede rõhk <35 cm H2O,
- FiO2 <0,6 .
Hingamistsükli parameetrite valikut teostatakse kuni piisava mehaanilise ventilatsiooni saavutamiseni, selle kriteeriumid on paO2 > 60 mm Hg, SpO2 > 88–93%, pvO2 35–45 mm Hg, SvO2 > 55%.
Üks efektiivseid meetodeid gaasivahetuse optimeerimiseks on kunstliku ventilatsiooni tegemine kõhuliasendis (tõendite kategooria B). See asend on efektiivne kõige raskema seisundiga patsientidel, kuigi selle mõju suremuse vähendamisele pikaajalisel perioodil on statistiliselt ebaoluline.
Toitumisalane tugi
Kunstliku toitumise toetamine on ravi oluline element, üks kohustuslikest meetmetest, kuna sepsise korral mitme organi puudulikkuse sündroomi tekkega kaasnevad tavaliselt hüpermetabolismi ilmingud. Sellises olukorras rahuldatakse energiavajadus oma rakustruktuuride hävitamisega (autokannibalism), mis süvendab elundite düsfunktsiooni ja suurendab endotoksikoosi.
Toitumistoetust peetakse raske kurnatuse (valgu-energia defitsiidi) ennetamise meetodiks kata- ja ainevahetuse märgatava suurenemise taustal. Enteraalse toitumise kaasamine intensiivravi kompleksi takistab soole mikrofloora liikumist, düsbakterioosi, suurendab enterotsüütide funktsionaalset aktiivsust ja soole limaskesta kaitsvaid omadusi. Need tegurid vähendavad endotoksikoosi astet ja sekundaarsete nakkuslike tüsistuste riski.
Toitumisalase toetuse arvutamine:
- energiaväärtus - 25–35 kcal/(kg kehakaalu kohta x päev),
- valgu kogus - 1,3–2,0 g/(kg kehakaalu kohta x päev),
- süsivesikute (glükoosi) kogus - alla 6 g/kg/päevas,
- rasva kogus - 0,5–1 g/kg/päevas,
- glutamiini dipeptiidid 0,3–0,4 g/kg/päevas,
- vitamiinid - standardne päevane komplekt + K-vitamiin (10 mg/päevas) + vitamiinid B1 ja B6 ( 100 mg/päevas) + vitamiinid A, C, E,
- mikroelemendid - standardne päevane kogus + Zn (15-20 mg/päevas + 10 mg/päevas lahtise väljaheite korral),
- elektrolüüdid - Na+, K+, Ca2+ vastavalt tasakaaluarvutustele ja plasmakontsentratsioonile.
Toitumisalase toe varajane alustamine (24–36 tundi) on efektiivsem kui intensiivravi 3.–4. päeval (tõendite kategooria B), eriti enteraalse sondiga toitmise korral.
Raske sepsise korral ei ole enteraalsel ega parenteraalsel toitmisel eeliseid; elundite düsfunktsiooni kestus ning hingamisteede ja inotroopse toe kestus on samad ning suremus on sama. Eelnevat arvesse võttes on varajane enteraalne toitmine odavam alternatiiv parenteraalsele toitmisele. Toidukiudainetega (prebiootikumidega) rikastatud segude kasutamine sondi kaudu toitmiseks vähendab oluliselt kõhulahtisuse esinemissagedust raske sepsisega patsientidel.
Organismis efektiivse valgusünteesi jaoks on oluline säilitada ainevahetussuhe "kogu lämmastik, g - mittevalgulised kalorid, kcal" = 1-(110-130). Süsivesikute maksimaalne annus on 6 g / (kg kehakaalu kohta päevas), kuna suurte annuste manustamine ähvardab hüperglükeemiat ja katabolismi aktiveerumist skeletilihastes. Rasvaemulsioone on soovitatav manustada ööpäevaringselt.
Toitumisalase toetuse vastunäidustused:
- dekompenseeritud metaboolne atsidoos,
- individuaalne talumatus toitainete suhtes,
- raskekujuline ravimata hüpovoleemia,
- refraktaarne šokk - dopamiini annus >15 mcg/(kg x min) ja süstoolne vererõhk <90 mm Hg,
- raske ravimatu arteriaalne hüpokseemia.
Glükeemiline kontroll
Raske sepsise kompleksse ravi oluline aspekt on vereplasma glükoosikontsentratsiooni pidev jälgimine ja insuliinravi. Kõrge glükeemia ja selle korrigeerimise vajadus on sepsise ebasoodsa tulemuse tegurid. Eeltoodud asjaolusid arvestades säilitatakse patsientidel normoglükeemia (4,5–6,1 mmol/l), mille korral, kui glükoosikontsentratsioon tõuseb üle vastuvõetavate väärtuste, tehakse insuliini infusioon (0,5–1 U/h). Sõltuvalt kliinilisest olukorrast jälgitakse glükoosikontsentratsiooni iga 1–4 tunni järel. Selle algoritmi rakendamisel täheldati patsientide elulemuse statistiliselt olulist suurenemist.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
Glükokortikoidid
Kaasaegsete uuringute tulemused glükokortikoidide kasutamise efektiivsuse kohta septilise šokiga patsientidel on kokku võetud järgmistes väidetes:
- Hormoonide kasutamine suurtes annustes [metüülprednisoloon 30–120 mg/(kg x päevas) üks kord või 9 päeva jooksul, deksametasoon 2 mg/(kg x päevas) 2 päeva jooksul, betametasoon 1 mg/(kg x päevas) 3 päeva jooksul] on sobimatu – suurenenud haiglainfektsioonide risk, elulemusele mõju puudub.
- Hüdrokortisooni kasutamine annuses 240–300 mg päevas 5–7 päeva jooksul kiirendab hemodünaamiliste parameetrite stabiliseerumist, võimaldab lõpetada veresoonte toe ja parandab elulemust patsientidel, kellel on samaaegne suhteline neerupealiste puudulikkus (tõendite kategooria B).
Prednisolooni ja deksametasooni kaootilisest empiirilisest väljakirjutamisest on vaja loobuda - uue teabe neile ekstrapoleerimiseks pole alust. Laboratoorsete tõendite puudumisel suhtelise neerupealiste puudulikkuse kohta manustatakse hüdrokortisooni annuses 300 mg päevas (3-6 süstina).
- refraktaarse šoki korral
- kui efektiivse hemodünaamika säilitamiseks on vaja suuri vasopressorite annuseid.
On võimalik, et septilise šoki süsteemse põletiku tingimustes on hüdrokortisooni efektiivsus seotud tuumafaktori kB inhibiitori (NF-kB-a) aktiveerimisega ja suhtelise neerupealiste puudulikkuse korrigeerimisega. Transkriptsiooni tuumafaktori (NF-kB) aktiivsuse pärssimine omakorda viib indutseeritava NO süntetaasi (NO on kõige võimsam endogeenne vasodilataator), põletikku soodustavate tsütokiinide, COX-i ja adhesioonimolekulide moodustumise vähenemiseni.
Aktiveeritud valk C
Üks sepsise iseloomulikke ilminguid on süsteemse koagulatsiooni häire (koagulatsioonikaskaadi aktiveerumine ja fibrinolüüsi pärssimine), mis viib lõpuks hüpoperfusioonini ja organite düsfunktsioonini. Aktiveeritud valgu C mõju põletikulisele süsteemile realiseerub mitmel viisil:
- selektiini kinnitumise vähenemine leukotsüütidele, mis kaitseb endoteeli kahjustuste eest ja millel on võtmeroll süsteemse põletiku tekkes,
- monotsüütide tsütokiinide vabanemise vähenemine,
- TNF-α vabanemise blokeerimine leukotsüütidest,
- trombiini tootmise pärssimine (see võimendab põletikulist reaktsiooni).
Antikoagulantne, profibrinolüütiline ja põletikuvastane toime
- Aktiveeritud valk C on tingitud
- faktorite Va ja VIIIa lagunemine - trombi moodustumise pärssimine,
- plasminogeeni aktivaatori inhibiitori pärssimine - fibrinolüüsi aktiveerimine,
- otsene põletikuvastane toime endoteelirakkudele ja neutrofiilidele,
- endoteeli kaitsmine apoptoosi eest
Aktiveeritud valgu C [drotrekogiin alfa (aktiveeritud)] manustamine annuses 24 mcg/(kg h) 96 tunni jooksul vähendab surmaohtu 19,4%. Manustamise näidustused: sepsis koos ägeda MOF-iga ja kõrge surmaohtuga (APACHE II > 25 punkti, 2 või enama organi düsfunktsioon, tõenduskategooria B).
Aktiveeritud valk C ei vähenda suremust lastel, ühe organi düsfunktsiooniga patsientidel, APACHE II < 25 punktiga patsientidel ega mittekirurgilise sepsisega patsientidel.
 [ 14 ], [ 15 ], [ 16 ], [ 17 ]
[ 14 ], [ 15 ], [ 16 ], [ 17 ]
Immunoglobuliinid
Immunoglobuliinide (IgG ja IgG+IgM) intravenoosse manustamise otstarbekus on seotud nende võimega piirata põletikku soodustavate tsütokiinide liigset toimet, suurendada endotoksiinide ja stafülokokkide superantigeeni kliirensit, kõrvaldada anergiat ja tugevdada ß-laktaamantibiootikumide toimet. Nende kasutamine raske sepsise ja septilise šoki ravis on ainus immunokorrektsiooni meetod, mis suurendab elulemust. Parim efekt registreeriti IgG ja IgM kombinatsiooni kasutamisel [RR = 0,48 (0,35–0,75), tõenduskategooria A]. Standardne annustamisskeem on 3–5 ml/(kg x päevas) 3 päeva järjest. Immunoglobuliinide kasutamisel saadi kõige optimaalsemad tulemused šoki varajases faasis ("soe šokk") ja raske sepsisega patsientidel (APACHE II skoor 20–25 punkti).
Süvaveenitromboosi ennetamine
Alajäsemete süvaveenitrombooside ennetamine mõjutab oluliselt sepsisega patsientide ravitulemusi (tõendite kategooria A). Selleks kasutatakse nii fraktsioneerimata kui ka LMWH-d. Madala molekulmassiga hepariinide peamised eelised on hemorraagiliste tüsistuste väiksem esinemissagedus, nõrgem mõju trombotsüütide funktsioonile ja pikaajaline toime (võib manustada üks kord päevas).
Seedetrakti stressihaavandite tekke ennetamine
See suund mängib olulist rolli raske sepsise ja septilise šokiga patsientide ravis soodsa tulemuse saavutamisel, kuna seedetrakti stresshaavandite verejooksu suremus on 64–87%. Ilma ennetavate meetmeteta tekivad stresshaavandid 52,8%-l kriitiliselt haigetest patsientidest. Prootonpumba inhibiitorite ja histamiini H2 retseptori blokaatorite kasutamine vähendab aga riski enam kui 2 korda (esimene ravimirühm on efektiivsem kui teine). Ennetamise ja ravi peamine suund on pH hoidmine vahemikus 3,5–6,0. Tuleb rõhutada, et lisaks ülaltoodud ravimitele mängib stressihaavandite tekke ennetamisel olulist rolli ka enteraalne toitumine.
Kehaväline vere puhastamine
Mitmesugused bioloogiliselt aktiivsed ained ja ainevahetusproduktid, mis on seotud üldise põletiku tekkega, on detoksifitseerimismeetodite sihtmärkideks, mis on eriti oluline loomuliku hepatorenaalse kliirensi puudumisel mitme organi puudulikkuse korral. Neeruasendusravi meetodeid peetakse paljulubavateks, kuna need võivad mõjutada mitte ainult neerupuudulikkusega patsientide ureemilisi häireid, vaid avaldada positiivset mõju ka teistele homöostaasi muutustele ja organite düsfunktsioonidele, mis esinevad sepsise, šoki ja mitme organi puudulikkuse korral.
Praeguseks puuduvad andmed, mis kinnitaksid vajadust kasutada kehaväliseid verepuhastusmeetodeid sepsise ja septilise šoki patogeneetilise ravi ühe peamise suunana. Nende kasutamine on õigustatud mitme organi puudulikkuse korral neerude domineerimise korral.
 [ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
[ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
Hemodialüüs
Meetodi olemus seisneb madala molekulmassiga ainete (kuni 5x103 Da) difusioonis läbi poolläbilaskva membraani ja liigse vedeliku eemaldamises organismist mööda rõhugradienti. Hemodialüüsi kasutatakse laialdaselt nii kroonilise kui ka ägeda neerupuudulikkusega patsientide raviks. Ainete difusioonikiirus sõltub eksponentsiaalselt nende molekulmassist. Näiteks oligopeptiidide eemaldamine on aeglasem kui nende süntees.
Hemofiltratsioon
Hemofiltratsioon on efektiivne meetod ainete eemaldamiseks molekulmassiga 5x103 - 5x104 Da ning ainus viis suure hulga bioloogiliselt aktiivsete ainete ja metaboliitide eemaldamiseks organismist. Meetod põhineb massiülekande konvektsioonimeetodil. Lisaks asoteemia piisavale korrigeerimisele eemaldab hemofiltratsioon efektiivselt anafülatoksiinid C3a, C5a, põletikku soodustavad tsütokiinid (TNF-α, IL-1b, 6 ja 8), ß2-mikroglobuliini, müoglobiini, paratüreoidhormooni, lüsosüümi (molekulmass - 6000 Da), α-amülaasi (molekulmass - 36 000-51 000 Da), kreatiinfosfokinaasi, aluselise fosfataasi, transaminaasid ja teised ained. Hemofiltratsioon eemaldab aminohappeid ja plasmavalke (sealhulgas immunoglobuliine ja ringlevaid immuunkomplekse).
Hemodiafiltratsioon
Hemodiafiltratsioon on vere puhastamise kõige võimsam meetod, mis ühendab difusiooni ja konvektsiooni (st GD ja GF). Täiendavat panust detoksifitseerimisprotsessile annab patoloogiliste ainete sorptsioon filtrimembraanile.
Plasmaferees
Plasmafereesi (plasmavahetus, plasmafiltratsioon) peetakse ka võimalikuks meetodiks üldise põletiku korrigeerimiseks sepsise ja septilise šokiga patsientidel. Optimaalseks meetodiks peetakse plasmavahetuse kasutamist pidevas režiimis, eemaldades 3-5 mahuosa plasmat ja asendades selle samaaegselt värskelt külmutatud, albumiini, kolloidsete ja kristalloidlahustega. Sõelumiskoefitsiendiga 1 tagab plasmafiltratsioon C-reaktiivse valgu, haptoglobiini, komplemendi fragmendi C3, 1-antitrüpsiini, IL-6, tromboksaan-B2, granulotsüüte stimuleeriva faktori ja TNF hea eemaldamise. Sorbentide kasutamine patsiendi plasma puhastamiseks vähendab nakkusohtu ja protseduuri maksumust, kuna puudub vajadus kasutada võõrvalke.
Naatriumseleniidi (selenaasi) pikaajaline infusioon annuses 1000 mcg/päevas raske sepsise korral viib suremuse vähenemiseni.
Seleen on oluline mikroelement, mille olulisus on seotud selle võtmerolliga rakkude antioksüdantsetes süsteemides. Seleeni tase veres püsib vahemikus 1,9–3,17 μM/l. Seleeni vajadus on 50–200 μg päevas ja see sõltub teiste antioksüdantide ja mikroelementide kättesaadavusest.
Seleen on võimas antioksüdant, glutatioonperoksidaasi, fosfoliinglutatioonperoksidaasi, teiste oksüdoreduktaaside ja mõnede transferaaside komponent. Glutatioonperoksidaas on endogeense antioksüdantsüsteemi kõige olulisem lüli.
Seleeni efektiivsust kriitilistes tingimustes on viimastel aastatel uuritud. Need uuringud on näidanud, et seleeni peamised toimemehhanismid on:
- NF-kB hüperaktiveerimise pärssimine;
- komplemendi aktivatsiooni vähenemine;
- selle toime immunomodulaatorina, antioksüdandina ja põletikuvastase ainena
- peroksiidi kasutamise säilitamine;
- endoteeli adhesiooni pärssimine (ICAM-1, VCAM-2 ekspressiooni vähenemine,
- E - selektiin, P - selektiin);
- endoteeli kaitsmine oksüradikaalide eest (selenoproteiin P abil, mis takistab peroksünitriti moodustumist O2-st ja NO-st).
Eelneva kokkuvõtteks võime määratleda raske sepsise intensiivravi konkreetsed ülesanded:
- Hemodünaamiline tugi: südame isheemiatõbi 8–12 mm Hg, keskmine vererõhk >65 mm Hg, diurees 0,5 ml/(kg/h), hematokrit >30%, segaveenilise vere küllastus >70%.
- Hingamistugevuse tipprõhk hingamisteedes <35 cm H2O, sissehingatava hapniku fraktsioon <60%, hingamismaht <10 ml/kg, mitte-inverteeritud sisse- ja väljahingatava õhu suhe.
- Glükokortikoidid - "väikesed annused" (hüdrokortisoon 240-300 mg päevas).
- Aktiveeritud valk C 24 mcg/(kg h) 4 päeva jooksul raske sepsise korral (APACHE II >25).
- Immunokorrektsiooni asendusravi pentaglobiiniga.
- Alajäsemete süvaveenitromboosi ennetamine.
- Seedetrakti stressihaavandite tekke ennetamine: prootonpumba inhibiitorite ja H2-histamiini retseptori blokaatorite kasutamine.
- Ägeda neerupuudulikkuse asendusravi.
- Toitumisalane tugi: toidu energiaväärtus 25–30 kcal/kg kehakaalu kohta x päevas), valgud 1,3–2,0 g/(kg kehakaalu kohta x päevas), glutamiinidipeptiidid 0,3–0,4 g/(kg x päevas), glükoos – 30–70% mittevalgulistest kaloritest, eeldusel, et glükeemia püsib <6,1 mmol/l, rasvad – 15–50% mittevalgulistest kaloritest.

