Aju glioom
Viimati vaadatud: 07.06.2024

Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
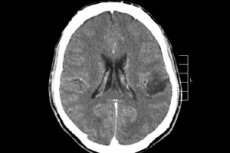
Kesknärvisüsteemi paljude kasvajaprotsesside hulgas diagnoositakse kõige sagedamini aju glioom - see termin on kollektiivne, neoplasm ühendab kõik hajutatud oligodendrogliaalsed ja astrotsüütilised fookused, astrotsütoom, astroblastoom ja nii edasi. Sellisel kasvajal võib olla erinev pahaloomuline kasvaja, moodustub gliaalstruktuuridest - rakkudest, mis on lokaliseeritud neuronite ümber. Glioomide peamine piirkond on peaaju poolkerad, aju vatsakeste seinad ja chiasma - nägemisnärvi kiudude osalise ristmiku pindala. Väliselt on kasvaja roosakas või punakas tooni, ümmarguse või spindli-kujulise konfiguratsiooni sõlmeline element, millel on eristamatute piiridega. [1]
Epidemioloogia
Ligikaudu 5% juhtudest on glioomid seotud pärilike patoloogiatega - eriti neurofibromatoosi ja muude domineeriva pärandiga sündroomidega. Eksperdid rõhutavad, et aju glioomide absoluutne enamus areneb juhuslikult - see tähendab ilma selge põhjuseta.
Üldiselt moodustavad kesknärvisüsteemi primaarsed neoplasmid umbes 2% kõigist kasvajatest ehk veidi üle 21 juhtumi saja tuhande elanikkonna kohta. Nende hulgas esinevad glioomid 35–36% juhtudest ja enam kui 15% neist on glioblastoomid.
Mõnede andmete kohaselt mõjutab glioom mehi sagedamini kui naisi - kasvaja on eriti levinud üle 50-aastaste inimeste seas.
Glioomide ülemaailmne esinemissagedus eakate seas on viimastel aastakümnetel märkimisväärselt suurenenud. Selle nähtuse põhjuseid pole veel kindlaks tehtud.
Maailma Terviseorganisatsiooni määratluse kohaselt on tuvastatud kolm peamist gliaalkasvajate varianti, mis erinevad nende histoloogiliste omaduste poolest. Need on oligodendroglioomid, astrotsütoomid ja kombineeritud oligoastrotsütoomid. Madala pahaloomulise patoloogia iga alatüübi esinemissagedust ei ole usaldusväärselt kindlaks määratud. Mõned uuringud näitavad oligodendroglioomide esinemissageduse suurenemist 5% -lt 30% -ni ja astrotsütoomide esinemissageduse vähenemist.
Gliaalkasvajad on võimelised infiltreeruma ajukoesse ja valdav enamus madala kvaliteediga fookustest muutub mõne aasta jooksul pahaloomuliseks. [2]
Põhjused aju glioomid
Aju glioom on terve rühm kasvajaprotsesse, mille ühine tunnus on nende moodustumine ajukoes asuvate kesknärvisüsteemi gliaalstruktuuridest. Sellised kasvajad jagunevad kaheks histopatoloogiliseks variandiks: kõrge pahaloomuline ja madal pahaloomuline glioom.
Kasvu moodustumise allikaks on neuroglia rakud (astrotsüüdid, oligodendrotsüüdid), mis pakuvad aju neuronite struktuurilist alust ja elujõulisust.
Gliaalkasvaja protsessid erinevad suuresti struktuuri, geenide mutatsioonimuutuste, agressiivsuse, kliiniliste tunnuste, diagnostiliste omaduste, ravi reageerimise ja patsientide prognoosi poolest. Kesknärvisüsteemi embrüonaalsed ja ependümaalsed neoplasmid - eriti medulloblastoomid ja ependümoomid - erinevad nende histoloogilise struktuuri poolest, kuid on ravi osas sarnased.
Gliaalielemendid klassifitseeriti esmakordselt 19. sajandi lõpus närvisüsteemi eraldi struktuurseks kategooriaks.
Neuroglia kude koosneb rakkudest, millel on abifunktsioonid: troofiline, tugi, kaitsev, sekretoorne. Neuronid ja gliotsüüdid eksisteerivad koos üksteisega, need moodustavad koos närvisüsteemi ja on organismi elutähtsa tegevuse üldistes protsessides väga olulised.
Gliotsüüdid liigitatakse laias laastus mitmeks peamiseks vormiks: astrotsüüdid, oligodendrotsüüdid, ependümaalsed rakud ja mikroglia.
Praeguseks ei saa teadlased vastata küsimusele neurogliaalse kasvaja moodustumise usaldusväärsete põhjuste kohta. Eeldatavasti annavad teatava negatiivse panuse radioaktiivsete mõjude, nakkushaiguste, joobeseisundi (eriti keemilise, tööalase) kaudu. Samuti on oluline pärilik tegur.
Aju glioomid tulenevad ebanormaalsetest neurogliotsüütidest, millel on geneetiline defekt, mis põhjustab ebanormaalset kasvu ja funktsionaalsust - selliseid struktuure nimetatakse "ebaküpseks". Mittetäielikud rakud asuvad sagedamini ühes piirkonnas, kus kasvaja moodustub.
Lihtsamalt öeldes on gliaalse moodustumine modifitseeritud neurogliarakkude kaootilise ja juhusliku kasvu tulemus. Protsess võib areneda ependümotsüütidest, oligodendrotsüütidest, astrotsüütidest (astrotsütoom, sealhulgas hiiglaslik rakk ja anaplastiline). [3]
Riskitegurid
Hoolimata asjaolust, et eksperdid ei saa täpselt iseloomustada gliaalse onkopatoloogiate moodustumise põhjuseid, saab mõnel juhul nende välimust ära hoida peamiste riskifaktorite kõrvaldamisega:
- Ioniseeriva kiirguse kokkupuutel on kantserogeenne toime, võib põhjustada leukeemia tekkimist ja tiheda struktuuriga vähiprotsesside moodustumist, sealhulgas noores eas inimestel. Sagedased ja ebamõistlikud radioloogilised meditsiinilised protseduurid, ultraviolettkiirgus (sealhulgas solaarium) kuuluvad ka potentsiaalsete kantserogeensete toimetesse ja võivad põhjustada kasvajate ilmnemist erinevates elundites, sealhulgas ajus.
- Tööalase kahjuliku mõju, joobes on sageli põhjuslik seos vähkkasvajate arenguga. Kummi ja klaasi, pestitsiidide ja kütuste, metallide ja tekstiilide, värvide ja laboratoorsete reagentide tootmist peetakse eriti ohtlikuks. Riskis on lennunduse, söe- ja metallitööstuse, keemiliste ja kõrvalsaaduste tootmisettevõtete, ehitusmaterjalide ja elektroodide, kütuste ja määrdeainete, plastide ja monomeeride töötajad.
- Õhk, vesi ja pinnase saastamine põhjustavad kuni 4% kõigist vähipatoloogiatest maailmas. Keskkonnas suurtes kogustes esinevad kantserogeenid sisenevad kehasse sissehingatava õhu, joogivee ja toiduga. Eriti ohtlikuks peetakse ökoloogiliselt ohtlikes piirkondades elamist - suurte tööstusrajatiste lähedal, hõivatud transpordi vaheldumisi.
- Nakkuslikud patoloogiad - eriti viirusnakkused - võivad ka kasvajate arenguks soodsaid tingimusi luua. Oluline on seda meeles pidada ja vaktsineerida, samuti ennetada nakkus- ja parasiithaigusi.
- Tubakat ja alkoholimürkimist peetakse paljude vähivormide, mitte ainult aju glioomide riskifaktoriteks.
- Ebapiisav füüsiline aktiivsus, ülekaaluline, ebaõige toitumine, ainevahetushäired, peavigastused, veresoonte patoloogiad - täiendavad stressifaktorid, mis võivad esile kutsuda rakusiseste häirete alguse.
- Vanem vanus on kehas neoplasmide arengu kõige levinum periood, nii et üle 55-aastased inimesed peaksid oma tervise eest eriliselt hoolitsema.
Glioomi arengu peamine ja kõige olulisem riskifaktor on endiselt pärilik eelsoodumus.
Pathogenesis
Praeguseks on ekspertidel aju glioomide arengu osas mitmeid eeldusi. Igal teoorial on oma alused, kuid ainus õige ja usaldusväärne patogeneetiline mehhanism, mida teadlased pole veel tuvastanud. Enamikul juhtudel räägime järgmistest teguritest neoplasmide väljatöötamisel:
Embrüogeneesi ebaõnnestumine, mis seisneb elundi paigaldamise häiretes ja "valede" rakustruktuuride moodustumises;
- Kokkupuude ioniseerivate kiirte, potentsiaalsete kantserogeenidega keemiliste ainete, toidulisandite jms kujul;
- Peatrauma;
- Geenihäired läksid põlvest põlve ("perekondlik" glioom);
- Immuunfunktsiooni häired, neuroinfektsioonid.
Enamikul glioomidel on hajunud kasv, tungides ümbritsevasse normaalsesse ajukoesse. Sõltuvalt pahaloomulise kasvaja astmest võib kasvaja tekkida mitu aastat ilma manifestatsioonita. Agressiivse kursuse korral suureneb sümptomatoloogia kiiresti mitme kuu jooksul.
Osa tuumorigeneesist on tingitud dümbrüogeneetilistest muutustest.
Ajutüve võib mõjutada erinevatel tasanditel: difuusne ajutüve glioom erineb omakorda nii anatomomorfoloogiliselt kui ka kliiniliselt. Mõned sellised neoplasmid - eriti kvadriplegia plaadi glioom - võivad olla suhteliselt healoomulised, ilma progresseerumise tunnusteta. Pontine glioomi seevastu iseloomustab selle eriline pahaloomuline kasvaja, agressiivsus ja halb prognoos.
Ajustruktuuride difuussed kahjustused, milles patoloogilises protsessis osalevad enam kui kolm suurte poolkera anatoomilist tsooni, võimaliku periventrikulaarse lahknemise ja läbipääsuga Corpus Call Call gliomatoosi kaudu. [4]
Kas aju glioom on pärilik?
Aju glioomi moodustumise hästi tõestatud risk on pärilik - see tähendab sarnaste või muude intratserebraalsete kasvajate olemasolu otsestes esivanemates või samas põlvkonnas. Radioaktiivne kokkupuude ja regulaarne või pikaajaline kontakt võimalike kantserogeenidega süvendavad olukorda.
Mitte ainult glioome saab pärdada, vaid ka haigusi, millega kaasneb kasvaja suurenenud kasv ilma lokaliseerimiseta-eriti võib see olla neurofibromatoosi 1. ja 2. tüüpi, li-fraumeni sündroom, Hippel-Lindau. Sageli tuvastatakse glioomirakkudes muutused teatud geenides või kromosoomides.
Peamised patoloogiad, mis on seotud glioomi arenguga inimestel, on kokku võetud tabelis:
Patoloogia |
Kromosoom |
Geen |
Neoplasma mitmekesisus |
Li-Fraumeni sündroom |
17р13 |
TR53 |
Neuroektodermaalsed neoplasmid, astrotsütoom. |
Neurofibromatoos |
17q11 |
NF1 |
Nägemisnärvi glioom, pilotsüütiline astrotsütoom, neurofibromatoos |
Turcotte'i sündroom |
3p21, 7p22 |
HMLH1, HPSM2 |
Astrotsütoom |
Mugula skleroos (Burneville'i sündroom). |
9q34, 16p13 |
TSC1, TSC2 |
Gigantotsellulaarne subpendüümiline astrotsütoom |
Sõltumata gliaalkasvaja olemusest, olgu see siis juhuslik juhtum või pärilik patoloogia, on see patoloogiliselt muudetud geeni ekspressiooni häire. Lisaks õppimismõjude tagajärjel moodustatud neoplasmidele on geneetiliste muutuste põhjused teistes olukordades ebaselged.
Sümptomid aju glioomid
Fokaalse sümptomatoloogia tunnused sõltuvad otseselt aju glioomi lokaliseerimise valdkonnast ja muutuvad igasuguste endokriinsete häirete, närvikoe kokkusurumise või lokaalsete hävitavate protsesside tagajärgedeks.
Kui neoplasm asub parietaalses tsoonis, domineerivad inimesel sellised ilmingud nagu krambid, sensoorsed häired, kuulmispuude.
Kui glioom on lokaliseeritud domineeriva poolkera piirkonnas, tuvastatakse kõnehäired, agraphia, agnosia.
Ajalise lobe neoplasmiga kaasnevad sageli krambihoogud, afaasia, haigushaiguse ja visuaalse funktsiooni ning hingeldusega.
Kui koljusisene rõhk suureneb, areneb vastav pilt koos visuaalsete väljade, silmalihaste halvatuse ja hemiplegia piiramisega.
Kasvaja protsessi spetsiifilisuse tõttu kaasnevad aju glioomiga alati neuroloogilised sümptomid suuremal või vähemal määral. Alguses on märgatav üldine nõrkus, patsient soovib pidevalt magada, töövõime on halvenenud, mõtteprotsessid aeglustuvad. Just selles etapis on suur oht teha vale diagnoosi ja seetõttu on vale ravi välja kirjutamine. Muude mittespetsiifiliste ilmingute hulgas:
- Vestibulaarsed häired, sealhulgas ebastabiilne kõnnak, tasakaalu kaotus (nt jalgratta- või ronimisreppide korral), tuimus jäsemetes jne;
- Nägemise järkjärguline halvenemine, visuaalse pildi kahekordistamine;
- Kuulmisfunktsiooni halvenemine;
- Läbinud kõne;
- Iiveldus ja oksendamine rünnakute vormis, sõltumata toidust või joogist;
- Mimiliste lihaste ja muude näolihaste nõrgenemine;
- Ebamugavustunne neelates;
- Regulaarsed peavalud (sageli hommikutundidel).
Kliiniline pilt laieneb ja halveneb järk-järgult: mõnel patsiendil juhtub see mõne nädala jooksul aeglaselt, teistel - järsult, sõna otseses mõttes "nende silme all". Viimasel juhul räägime aju agressiivsest, kiiresti arenevast glioomist.
Esimesed märgid
Aju glioomi varajases staadiumis ei ole väljendunud sümptomatoloogia. Esimesed manifestatsioonid eksivad sageli teiste, vähem ohtlike patoloogiate tunnuste osas.
Üldiselt on glioomi kliiniline pilt mitmekesine ja selle määrab patoloogilise fookuse asukoht ja suurus. Neoplasma kasvades arenevad ja suurenevad üldised aju sümptomid:
- Püsiv ja regulaarne peavalu, mis ei reageeri standardsetele ravimitele (mittesteroidsed põletikuvastased ravimid);
- Vahelduv iiveldus, mõnikord oksendamise punktini;
- Ebamugav, raske tunne silmamuna piirkonnas;
- Krambid.
Tserebraalsed ilmingud on eriti intensiivsed, kui kasvaja kasvab vatsakestesse või liköörisüsteemi. Tserebrospinaalvedeliku äravool on kahjustatud, koljusisene rõhk suureneb ja areneb hüdrotsefaalia. Protsess mõjutab teatud ajuosa, mis mõjutab vastava kliiniku arengut:
- Visuaalse funktsiooniga on probleeme;
- Kõne kahjustatud;
- Esinevad vestibulaarsed häired (pearinglus, liikumiste halvenenud koordineerimine);
- Parees, käte halvatus, jalad;
- Mälu ja kontsentratsioon on halvenenud;
- Mõtteprotsessid on halvenenud;
- Tekib käitumishäired.
Esialgses etapis puuduvad sümptomid praktiliselt või on need nii tähtsusetud, et nad ei köida tähelepanu. Just sel põhjusel soovitavad eksperdid kindlalt regulaarselt ennetavaid uuringuid ja kontrolli. Lõppude lõpuks, mida varasem kasvajaprotsess tuvastatakse, seda suuremad on ravi ja ellujäämise võimalused. [5]
Aju glioom lapsel
Lapsepõlves leitud paljude ajukasvajate hulgas on glioomide protsent vahemikus 15–25%. Lapsed saavad haigust oma teismeeas ja kahekümnendate aastate alguses, ehkki alla 3-aastaste imikute jaoks on haiguse saamiseks väga haruldane.
Patoloogia algab gliaalrakkude mutatsiooni taustal. Praeguseks pole vastust küsimusele, miks see mutatsioon toimub.
Ainus, mis on usaldusväärselt õpitud, on see, et teatud pärilikud haigused, mis on seotud kasvaja kasvu suurenenud riskiga, suurendavad ka aju glioomi tekkimise tõenäosust.
Lisaks on teadlased leidnud, et gliaalrakkudel võib olla üksikute geenide või kromosoomide erinevus. Selle häire tõttu lööb sisse mutatsioonimehhanism, mis pole pärilik. Võimalik, et see toimub ühes varasemas arenguetapis.
On tõestatud tõsiasi, et ägeda leukeemia või retinoblastoomi esinemine lapse ajaloos või ajukiirgus muul põhjusel suurendab märkimisväärselt glioomi moodustumise riske (teatud aja pärast).
Lapsepõlves sümptomatoloogia sõltub pahaloomulise kasvaja astmest ja patoloogilise fookuse lokaliseerimisest. Eristatakse konkreetseid ja mittespetsiifilisi sümptomeid:
- Mittespetsiifilised sümptomid ei ole "seotud" piirkonnaga, kus glioom asub. Levinumad ilmingud võivad hõlmata peavalu, pearinglust, kehva isu, oksendamist ilma toidutarbimiseta, kaalulangusega (teadmata põhjustel), pidev väsimustunne, akadeemilise jõudluse langus, keskendumisraskused, käitumishäired. Need märgid on tingitud koljusiseste struktuuride kokkusurumisest, mida võib seletada kasvava massi otsese rõhuna ja häiret tserebrospinaalvedeliku ringluses. Aju süsivesinike oht on olemas.
- Spetsiifiline sümptomatoloogia sõltub gliaalse patoloogilise fookuse otsesest asukohast. Näiteks kaasneb väikeaju kasvajaga tavaliselt lastel halvenenud kõnnak ja tasakaal. Suure aju kahjustus avaldub krambihoogude ja seljaaju kasvaja kasvuga lihaste halvatuse korral. Juhtub, et lapse nägemine halveneb järsult, teadvus on häiritud, uni halveneb või tekivad mõni muu arenguprobleem.
Reeglina ilmutab pahaloomuline glioom lapsepõlves mõne nädala või kuu pärast selle arengut: seda iseloomustab sageli neoplasmi kiire ja kontrollimatu kasv.
Pahaloomuliste gliaalkasvajatega lapsi ravivad laste onkoloogiale spetsialiseerunud laste kliiniliste keskuste arstid. Reeglina kasutatakse kirurgilist ravi, kiirgus- ja keemiaravi kursusi.
Kõige olulisem ravi samm on neurokirurgia. Mida radikaalsem see on, seda parem on lapse võimalused raviks. Kuid kirurgiline sekkumine pole alati võimalik: eriti võib tekkida probleeme ajutüve glioomide eemaldamisega, samuti alla 3-aastaste laste kiirguse korral.
Kesk-aju glioome (kesk- ja kesk-aju) on keeruline täielikult eemaldada, kuna tervisliku kudede kahjustamiseks on oht. Kui kasvaja täielik resektsioon on võimatu, määratakse patsiendile palliatiivne ravi.
Pahaloomuliste glioomidega lapsi töödeldakse vastavalt standardiseeritud protokollidele, mis on määratud rangelt kontrollitud kliiniliste uuringute kaudu. Kõige tavalisemad protokollid on järgmised:
- HIT HGG 2007: hõlmab 3-17-aastaste laste ravi.
- Hit SKK: sobib imikutele (kuni kolm aastat) ja ei hõlma kiiritusravi.
Glioomide pediaatriline ellujäämisstatistika ei ole üldiselt eriti optimistlik. Kuid mingil juhul ei ole võimalik ette näha konkreetse lapse ravimeetmete tõhusust. Oluline on hoolikalt järgida kõiki arsti korraldusi, mis suurendab märkimisväärselt taastumise võimalusi.
Vormid
Glioomid võivad olla madala pahaloomulise ja kõrge pahaloomulise, intensiivse kasvu ja kalduvusega metastaaseerida. Oluline on mõista, et madal pahaloomuline kasvaja ei ole kasvaja ohutuse sünonüüm. Iga aju neoplasm loob täiendava mahu, pigistab aju struktuure, mis põhjustab nende nihkumist ja suurenenud koljusisese rõhku. Selle tulemusel võib patsient surra.
Pahaloomulisi astrotsütoome on kahte peamist tüüpi. Need on glioblastoomid ja anaplastilised astrotsütoomid, mis on jaotatud molekulaarsete muutuste järgi. Astrotsütoomidest tekkinud ja madala pahaloomulise kasvaja sekundaarsed pahaloomulised kasvajad leidub kõige sagedamini noortel patsientidel. Algselt esinevad pahaloomulised gliaal-tüüpi kasvajad sagedamini eakatel patsientidel.
Sõltuvalt struktuurilisest asukohast tulevad glioomid sisse:
- Supratentoriaalne (lokaliseerimisega väikeaju kohal külgmiste vatsakeste piirkonnas, suur poolkerad);
- Pedentoriaalne (lokaliseerimisega väikeaju all tagumises kraniaalfossas).
Histoloogiliste tunnuste kohaselt eristab seda tüüpi glioomi:
- Astrotsüütiline glioom on kõige tavalisem. See omakorda jaguneb sõlmeliseks ja hajusaks (viimast saab iseloomustada kiire kasv ja insuldimuster).
- Oligodendroglioom - esineb 5% -l patsientidest. Sellel on petrificatid - kaltsifitseerimispiirkonnad, enamasti eesmises lobes.
- Ependümaalne glioom - kasvab seljaaju keskkanali ja vatsakeste keskkanali seinte vooderdavatest struktuuridest. Kasvab sageli aju aine paksuseks, aga ka aju valendikusse.
Võimalikud on samuti võimalikud segatud patoloogilised fookused nagu subependümoom, oligoastrotsütoom jne.
Kõik glioomid liigitatakse järgmistesse etappidesse:
- Aeglaselt kasvav suhteliselt healoomulised neoplasmid ilma ilmsete kliiniliste sümptomiteta.
- Aeglaselt kasvavad "piiriülesed" glioomid, mis muutuvad järk-järgult III etapiks ja kaugemale.
- Pahaloomuline glioom.
- Pahaloomuline glioom intensiivse agressiivse kasvu ja levikuga, halva prognoosiga.
Mida madalam on pahaloomulisuse etapp, seda vähem metastaaside tõenäosust ja eemaldatud neoplasma kordumist ning seda suuremad on patsiendi ravivõimalused. Suurima ohu kujutab glioblastoomi multiforme, madala diferentseerunud protsess koos intensiivse kasvu ja arenguga. [6]
Neuroglioomi võimalikud ja levinumad variandid:
- Ajutüve ja pontiini kahjustustega glioom asub piirkonnas, kus aju ühendab seljaaju. Just seal lokaliseeritakse olulised hingamisteede, südame ja motoorse funktsiooni eest vastutavad neurotsentrid. Kui see tsoon on kahjustatud, on vestibulaar- ja kõneaparaadi töö häiritud. Seda tuvastatakse sageli lapsepõlves.
- Visuaalne glioom mõjutab nägemisnärvi ümbritsevaid neurogliaalseid rakke. Patoloogia põhjustab visuaalse kahjustuse ja eksoftalmosid. See areneb sagedamini lastel.
- Madalat pahaloomulist neuroglioomi iseloomustab aeglane kasv, lokaliseerub sagedamini suurtes poolkerades ja väikeaju. Seda esineb sagedamini noortel (noorukid ja umbes 20-aastased täiskasvanud).
- Corpus Callosumi glioom on iseloomulikum 40–60-aastastele inimestele ja seda esindab kõige sagedamini glioblastoom.
- Chiasma glioom lokaliseeritakse optilise ristmike tsoonis, nii et sellega kaasnevad müoopia, visuaalse välja kadu, oklusiivsed hüdrotsefaalia ja neuroendokriinsed häired. See võib ilmneda igas vanuses, kuid mõjutab kõige sagedamini I tüüpi neurofibromatoosiga patsiente
Tüsistused ja tagajärjed
Madala pahaloomulise kasvaja glioomid (I-II aste, väga pahaloomuline - nt astrotsütoom, oligoastrocytom, oligodendroglioom, pleomorfne ksanthoastotsütoom jne) ja kõrge pahaloomuline (III-IV aste - anapostiline oligoglioom). IV astme glioomid on eriti pahaloomulised.
Ajutüve glioomil on väga ebasoodne prognoos just seetõttu, et neoplasm mõjutab sellist ajupiirkonda, kus kõige olulisemad närviühendused aju ja jäsemete vahel on kontsentreeritud. Isegi üsna väikesest kasvajast selles piirkonnas piisab, et patsiendi seisund kiiresti halveneb ja halvatuse esile kutsuda.
Mitte vähem ebasoodsad tagajärjed ilmnevad siis, kui mõjutavad teisi ajupiirkondi. Sageli on see ajukoore kasvaja, mis ei anna hoolimata ravist võimalust patsiendi pika eluea jaoks. Sageli on võimalik surma edasi lükata.
Meditsiinistatistika kohaselt on viieaastane elulemus sageli vaid 10-20%. Kuigi need arvud sõltuvad suuresti nii pahaloomulise kasvaja astmest kui ka tehtud kirurgilise sekkumise täpsest lokaliseerimisest ja mahust. Pärast patoloogilise fookuse täielikku eemaldamist suureneb ellujäämismäär märkimisväärselt (mõnikord - kuni 50%). Ravi puudumine või selle võimatu (ühel või teisel põhjusel) on garanteeritud patsiendi surma.
Enamik madalatest pahaloomulistest gliaalkasvajatest on võimelised mitme aasta jooksul infiltreeruma ja pahaloomuliseks.
Eksperdid peavad glioomi kordumise riski "väga tõenäoliseks". Sellegipoolest ei tohiks ravi tähelepanuta jätta: oluline on tagada hea elukvaliteet nii kaua kui võimalik.
Korduvatel glioomidel on alati halvem prognoos kui primaarkasvajatel. Terapeutilistel optimeerimise uuringutel põhinevad kaasaegsed raviprotokollid saavutavad sageli piisavalt häid tulemusi patsientidele, kellel on isegi väga pahaloomulised neoplasmid.
Võimalikud tulemused pärast keemiaravi:
- Väljaõit, vägemine, seedehäired, suuhaigused;
- Kesknärvisüsteemi suurenenud erutuvus, asteenia;
- Kuulmisfunktsiooni halvenemine, tinnitus ja kõrvus helisemine;
- Krambid, depressiivsed häired;
- Hüpertensiooniline kriis, veremustri muutus;
- Neerupuudulikkus;
- Allergilised protsessid, juuste väljalangemine, pigmendilaikude ilmumine kehale.
Pärast keemiaravi märgivad patsiendid immuunsussüsteemi väljendunud nõrgenemist, mis võib põhjustada mitmesuguste nakkuslike patoloogiate tekkimist.
Diagnostika aju glioomid
Aju glioomi võib kahtlustada järgmiste märkidega:
- Patsiendil on lokaliseeritud või üldistatud krampe, mis on iseloomulikud neoplasma kortikaalsele asukohale ja selle aeglasele arengule. EPI-seizure leidub 80% -l madala kvaliteediga gliaalkasvajatega patsientidest ja 30% -l patsientidest, kellel on kõrge astme glioomid.
- Suurenenud koljusisene rõhk on eriti iseloomulik massidele, mis asuvad paremas esi- ja parietaalses lobes. Vere vereringe ja vedeliku ringluse kõrge koljusisese rõhuhäirega on seotud pideva ja suureneva peavalu ilmnemist, iiveldust oksendamise, visuaalsete häirete, uimaduse korral. Seal on nägemisnärvi tursed, suunava närvi halvatus. Koljusisese surve suurenemine kriitilistele väärtustele võib põhjustada kooma ja surma arengut. Teine kõrge IOP põhjus on hüdrotsefaalia.
- Patsiendil on kasvav fookuspilt. Supratentoriaalsetes moodustistes on motoorsed ja sensoorsed sfäärid häiritud, hemioopia, afaasia ja kognitiivsed häired edenevad.
Kui arst kahtlustab aju neoplasma olemasolu, on optimaalne teha MRI-d ilma kontrastaine (Gadoliinium) kasutuselevõtuta või selle alustamisega, et teada saada selle asukoht, suurus ja täiendavad omadused. Kui magnetresonantstomograafia pole võimalik, viiakse läbi kompuutertomograafia ja diferentseerumismeetodina kasutatakse magnetresonantsspektroskoopiat. Hoolimata nende diagnostiliste meetodite informatiivsusest, tehakse lõplik diagnoos alles pärast histoloogilist kinnitust kasvaja fookuse resektsiooni ajal.
Ülaltoodud kriteeriume arvestades on soovitatav alustada diagnoosimist põhjaliku ajalooga, somato-neuroloogilise seisundi ja funktsionaalse seisundi hindamisega. Neuroloogilist seisundit hinnatakse koos tõenäoliste intellektuaalsete ja mnestiliste häirete määramisega.
Soovitatavad laboratoorsed testid:
- Täielik üldine kliiniline veretöö;
- Täisvere keemia paneel;
- Uriinianalüüs;
- Vere hüübimise uuring;
- Onkoloogiliste markerite analüüs (AFP, BETA-HCG, LDH - asjakohane, kui kahtlustatakse käbinõude kahjustust).
Glioblastoomi ja anaplastilise astrotsütoomiga patsientide prognostiliste punktide selgitamiseks hinnatakse IDH1 | 2-1 geenimutatsiooni ja MGMT geeni metüülimist. Oligodendroglioomi ja oligoastrotsütoomiga patsientidel määratakse 1p | 19Q CodleLation.
Instrumentaalset diagnostikat esindab esiteks aju kohustuslik magnetresonantstomograafia (mõnikord - ja seljaaju). MRI viiakse läbi kolmes projektsioonis, kasutades standardset T1-2, Flair, T1 režiimid kontrastiga.
Kui see on näidatud, siis veresoonte võrgu ultraheli, motoorsete ja kõneosade funktsionaalne magnetresonantstomograafia, samuti angiograafia, spektroskoopia, MR-traktograafia ja perfusioon.
Täiendavad uurimised võivad hõlmata järgmist:
- Aju elektroentsefalograafia;
- Konsultatsioonid neurokirurgi, onkoloogi, radioloogi, silmaarsti, radioloogiga.
Diferentseeritud diagnoos
Diferentsiaaldiagnostika toimub tingimata mitte-kasvaja patoloogiaga-eriti arterio-venoosse või arteriaalse väärarengu põhjustatud hemorraagiaga, samuti pseudotumor-demüeliniseerivate protsesside, põletikuliste haiguste (toksoplasmoos, aju abstressi jms).
Lisaks eristab kasvaja primaarset fookust ja kesknärvisüsteemi metastaase.
Kaasaegsete magnetresonantstomograafiavõimaluste abil on võimalik diagnostilisi mõõtmeid piisavalt täpselt läbi viia, et teada saada kesknärvisüsteemi põhitootmise päritolu. Aju MRT viiakse läbi kontrastiga või ilma, T1, T2 Flair režiimis - kolmes projektsioonis või õhukesed viilud aksiaalprojektsioonis (SPGR-režiim). Need diagnostilised meetodid võimaldavad täpselt kindlaks teha neoplasma asukoha, suuruse, struktuuriliste omaduste, selle seose veresoonte võrgu ja läheduses asuvate ajupiirkondadega.
Lisaks võib diferentsiaaldiagnostika osana läbi viia CT (koos kontrastiga või ilma), CT angiograafia (MR angiograafia), MR-traktograafia, MR või CT perfusiooni. Aju CT/PET koos metioniini, koliini, türosiini ja muude aminohapetega kasutatakse näidul.
Ravi aju glioomid
Spetsiifiline teraapia koosneb kirurgilistest, kemoterapeutilistest ja kiiritusmeetmetest. Võimaluse korral on kohustuslik läbi viia kasvaja fookuse täielik resektsioon, mis võimaldab sümptomite kiiret leevendamist ja diagnoosi histoloogilist kinnitust.
Kiiritamisel on positiivne mõju patsientide eeldatava eluea suurendamisele. Standardina manustatakse kogu annus 58–60 Gy, mis on jagatud individuaalseteks kiiritusdoosideks 1,8-2 Gy. Kasvajat kiiritatakse kohapeal, jäädvustades lisaks selle ümber kuni 3 cm. Kiiritusravi on vastuvõetavam kui brahhüteraapia. Mõnel juhul on soovitatav radiosurgilisi meetodeid, mis koosnevad gamma noa või lineaarse gaasipedaaliga kiiritamisest, samuti neutron-püüdmise boorraviga.
Vajadus adjuvandi keemiaravi järele on vaieldav. Mõnel juhul võimaldasid nitrosoureapreparaadid suurendada patsientide eeldatavat eluiga kuni pooleteise aastani, kuid mõned selliste kemopreparaatide kasutamise tulemused olid negatiivsed. Tänapäeval kasutatakse aktiivselt tsütotoksilisi aineid, neoadjuvantravi (enne kiirgust), kombineeritud ravimeid, arteriaalset keemiaravi või suure annusega keemiaravi.
Üldiselt on glioomide edukaks raviks terviklik lähenemisviis väga oluline, mille ulatus sõltub massi, selle suuruse ja patsiendi üldise tervisega pahaloomulise kasvaja asukohast ja astmest.
Ajutüve glioomi suhtes kasutatakse kirurgilist sekkumist harva. Peamine operatsiooni vastunäidustus on fookuse lokaliseerimise valdkond - elutähtsate osade läheduses. Mõnel juhul on võimalik eemaldada pagasiruumi glioom, kasutades mikrokirurgilisi meetodeid koos operatsioonieelse ja operatsioonijärgse keemiaravi abil. Selline sekkumine on väga keeruline ja nõuab neurokirurgi erilist kvalifikatsiooni.
Kiirgusoperatsioon ja eriti stereotaktiline operatsioon, mis on kokkupuute kõrge ioniseeriva annusega, on üsna tõhus. Sellise tehnika kasutamine neoplasma arengu varajases staadiumis võimaldab mõnikord saavutada patsiendi pikaajalist remissiooni või isegi täielikku ravi.
Kiirgust kombineeritakse sageli keemiaraviga, mis parandab sekkumiste tõhusust ja vähendab kiirguskoormust. Glioomides ei ole kõik kemopreventiivsed ained terapeutiliselt edukad, seetõttu on need eraldi ette nähtud ja vajadusel retsepte kohandatakse.
Valu ja madalama koljusisese rõhu vähendamiseks on sõltumata peamisest ravist välja kirjutatud sümptomaatiline ravi - eriti kortikosteroidide ravimid, valuvaigistid, rahustid.
Ravimid
Kortikosteroidravimid mõjutavad turset, vähendavad mitme päeva jooksul neuroloogiliste sümptomite raskust. Kuid mitmete kõrvaltoimete ja keemiaravi ravimitega seotud ebasoodsate interaktsioonide suurenenud tõenäosuse tõttu kasutatakse steroidide minimaalselt tõhusaid annuseid, katkestades need nii kiiresti kui võimalik (nt pärast operatsiooni).
Vastavaid aineid kasutatakse süstemaatiliselt sekundaarse ennetava meetmena patsientidel, kes on juba kogenud epilepsia krampe. Need ravimid võivad põhjustada tõsiseid kahjulikke sümptomeid ja suhelda ka keemiaravi ravimitega.
Antikoagulandid on eriti olulised operatsioonijärgses staadiumis, kuna tromboflebiidi moodustumise riskid glioomis on üsna kõrged (kuni 25%).
Antidepressantide-anksiolüütika võtmisel on oodata head mõju. Metüülfenidaadi kasutamine 10–30 mg/päevas kahes annuses võimaldab sageli optimeerida kognitiivseid võimeid, parandada elukvaliteeti, säilitada töövõimet.
Ajuturse neuroloogilised ebaõnnestumised ja tunnused (valu pea, teadvuse häired) elimineerivad kortikosteroidravimid - eriti prednisoloon või deksametasoon. |
Kortikosteroidide skeem ja annustamine valitakse individuaalselt, minimaalse efektiivse annusega. Ravi kursuse lõpus eemaldatakse ravimid järk-järgult. |
Kortikosteroide võetakse koos gastroprotektiivsete ravimitega-prootonpumba blokaatorite või H2-histamiini-Blokeerijad. |
Diureetikumid (furosemiid, mannitool) on ette nähtud ajustruktuuride tõsiseks turseks ja nihutamiseks kortikosteroidravimite täiendina. |
Konvultiivsete krambide (sealhulgas anamneesi) või elektroentsefalogrammi sümptomite korral on krambivastane ravi välja kirjutatud lisaks. Vastavaid antikontsente ei ole profülaktilistel eesmärkidel ette nähtud. |
Patsientidel, kellel on keemiaravi näidustused, on soovitatav võtta krambivastaseid aineid, mis ei mõjuta maksaensüümi funktsiooni. Valitud ravimid: lamotrigiin, valproehape, levetiratsetam. Ei tohiks kasutada: karbamasepiin, fenobarbitaal. |
Peavalu aju glioomides ravitakse kortikosteroidravi abil. |
Mõnel juhul võib kasutada mittesteroidseid põletikuvastaseid ravimeid või tramadooli. |
Kui patsient võtab mittesteroidseid põletikuvastaseid ravimeid, lõpetatakse need mõni päev enne operatsiooni, et minimeerida operatsiooni ajal verejooksu. |
Valitud valujuhtudel võib soovitada narkootilisi analgeetikume - näiteks fentanüüli või trimeperidiini. |
Kopsuemboolia vältimiseks kolmandast operatsioonijärgsest päevast on ette nähtud madala molekulmassiga hepariinide manustamine - eriti enoksapariini naatriumi või Nadropariini kaltsiumi - manustamine. |
Kui patsient tegeleb süstemaatilise antikoagulandi või antiagregantse raviga, kantakse ta madala molekulmassiga hepariinidesse hiljemalt nädal enne kirurgilist sekkumist, nende edasist loobumist päev enne operatsiooni ja jätkake 24-48 tundi pärast operatsiooni. |
Kui glioomiga patsiendil on alajäsemete venoosne tromboos, viiakse läbi ravi otseste antikoagulantidega. CAVA-filtri paigutamise võimalust ei välistata. |
Keemiaravi aju pahaloomuliste glioomide jaoks
Glioomide peamisi kasvajavastaseid keemiaravi režiime peetakse:
- Lomustiin 100 mg/m² esimesel päeval, vinkristiin 1,5 mg/m² esimesel ja kaheksal päeval, procarbazine 70 mg/m² alates päevast kaheksa kuni kakskümmend esimest, kursused iga kuue nädala tagant.
- Lomustiin 110 mg/m² iga kuue nädala tagant.
- Temozolomiid 5/23 150 kuni 200 mg/m² alates päevast kuni viieni, iga 28 päeva järel.
- Temosolomiid osana kemoteraadi töötlemisest, iga päev 75 mg/m².
- Temosolomiid tsisplatiini või karboplatiiniga (80 mg/m²) ja temosolomiid 150-200 mg/m² päevadel 1–5 iga 4 nädala järel.
- Temozolomiid 7/7 kiirusel 100 mg/m² kursuse päevadel 1-8 ja 15-22, korrata iga nelja nädala tagant.
- Bevacizumab 5–10 mg/kg esimesel ja viieteistkümnel päeval ning Irinotecan 200 mg/m² esimesel ja viieteistkümnel, korrati iga nelja nädala tagant.
- Bevacizumab 5–10 mg/kg esimesel päeval, viisteist ja kakskümmend üheksa ning Lomustiin 90 mg/m² esimesel päeval iga kuue nädala tagant.
- Bevacizumab 5–10 mg/kg esimesel ja viieteistkümnel, Lomustine 40 mg esimesel päeval, kaheksa, viisteist ja kakskümmend kaks, korrati iga kuue nädala tagant.
- Bevacizumab 5–10 mg/kg esimesel ja viieteistkümnel päeval, mida korratakse iga nelja nädala tagant.
Tsütostaatilised ravimid pärsivad paljudel juhtudel edukalt kasvajarakkude kasvu, kuid ei näita selektiivsust tervete kudede ja elundite suhtes. Seetõttu on eksperdid tuvastanud mitmeid vastunäidustusi, milles glioomi keemiaravi on võimatu:
- Liigne individuaalne tundlikkus kemopreventiivsete ainete suhtes;
- Südame-, neeru-, maksafunktsiooni dekompensatsioon;
- Depressioonis hematopoees luuüdis;
- Neerupealiste funktsiooniprobleemid.
Keemiaravi manustatakse äärmise ettevaatusega:
- Oluliste südamerütmi häiretega patsiendid;
- Diabeediga;
- Ägedate viirusnakkuste jaoks;
- Eakatele patsientidele;
- Kroonilise alkoholismi all kannatavad patsiendid (krooniline alkoholimürk).
Keemiapreventiivsete ravimite kõige tõsisem kõrvaltoime on nende toksilisus: tsütostaatilised segavad valikuliselt vererakkude funktsionaalsust ja muudavad nende koostist. Selle tagajärjel väheneb trombotsüüdid ja erütrotsüütide mass ja areneb aneemia.
Enne patsiendi keemiaravi määramist võtab arst alati arvesse ravimite toksilisuse astet ja tõenäolisi komplikatsioone pärast nende kasutamist. Keemiaravi kursusi jälgivad spetsialistid ja regulaarset vereseiret alati hoolikalt.
Tsütostaatilise ravi võimalikud tagajärjed:
- Hauduvus, vägemine;
- Toidu neelamisraskused, kuivad limaskestad, periodontiit, düspepsia;
- Kesknärvisüsteemi ebastabiilsus, maania-depressiivsed häired, krambiündroom, asteenia;
- Kuulmisfunktsiooni halvenemine;
- Vererõhu tõus kuni hüpertensiooni kriisi tekkeni;
- Trombotsüütide, punaste vereliblede, valgete vereliblede, mitu hemorraagia vähenemine, sisemine ja väline verejooks;
- Neerupuudulikkus;
- Allergilised protsessid;
- Juuste väljalangemine, suurenenud pigmentatsiooni piirkondade ilmnemine.
Pärast keemiaravi kursusi on patsientidel suurenenud nakkushaiguste tekkimise oht ning lihased ja liigesevalu on tavaline.
Ebasoodsajärgse mõju riski vähendamiseks on tingimata ette nähtud edasised rehabilitatsioonimeetmed, mille eesmärk on taastada normaalne verearvestus, südame-veresoonkonna aktiivsuse stabiliseerimine, neuroloogilise seisundi normaliseerimine. Piisavat psühholoogilist tuge kasutatakse tingimata.
Kirurgiline ravi
Operatsioon tehakse nii palju kui võimalik kasvaja fookuse eemaldamiseks, mis omakorda peaks vähendama koljusisene survet, vähendama neuroloogilist puudulikkust ja pakkuma teadusuuringute jaoks vajalikku biomaterjali.
- Operatsioon toimub spetsialiseeritud neurokirurgilises osakonnas või kliinikus, mille spetsialistid on kogenud neuro-onkoloogiliste sekkumiste alal.
- Kirurg pääseb luuperioodil plastikust glioomi lokaliseerimise piirkonnas.
- Kui neoplasm asub anatoomiliselt motoorsete piirkondade või radade lähedal või tuumades või kraniaalsetes närvides, kasutatakse intraoperatiivset neurofüsioloogilist jälgimist.
- Neuronavigatsioonisüsteemid, intraoperatiivne fluorestsents-navigeerimine 5-aminolevuleenhappega on soovitav, et maksimeerida neoplasmi eemaldamist.
- Pärast sekkumist viiakse läbi kontroll-CT või MRI (koos kontrastainega või ilma) 1.-2-päeval.
Kui glioomi kirurgiline resektsioon on võimatu või algselt tunnustatud kui ebasobivatena või kui kahtlustatakse kesknärvisüsteemi lümfoomi, siis viiakse läbi biopsia (avatud, stereotaktiline, navigeerimise jälgimisega jne). |
Tserebraalse gliomatoosiga patsiente kontrollitakse stereotaktilise biopsia abil, kuna terapeutiline taktika sõltub suuresti histoloogilisest pildist. |
Teatud olukordades - eakatel patsientidel, raskete neuroloogiliste häirete korral, on sümptomite ja pildistamise teabe põhjal kavas ravitel ja muudes elutähtsates osades glioomi lokaliseerimise korral. |
Resektsiooni või avatud biopsia läbiviimiseks on soovitatav patsientidel, kellel on pilaidsed astrotsütoomi, samuti ajutüve neoplasmide ja eksofüütiliste protsesside sõlmevormid. |
Hajuse pontiini glioomi ja muude pagasiruumi difuussete neoplasmidega patsiente ravitakse kiirguse ja kasvajavastase ravimi raviga. Sellistel juhtudel pole kontrollimine vajalik. |
Neljaplegilise plaadi glioomiga patsiendid läbivad süstemaatilise magnetresonantsi ja kliinilise jälgimise pärast aju hüdrokeeli eemaldamist. Kui neoplasmas näitab kasvu tunnuseid, eemaldatakse see edasise kiiritamisega. |
Madala astme pahaloomulise glioomi osalise resektsiooni või biopsia korral ravitakse kahe või enama riskifaktoriga patsiente tingimata kiirguse ja/või keemiaraviga. |
Kogu resektsioon on kohustuslik subependümaalse hiiglasliku raku astrotsütoomiga patsientide jaoks. |
Everoliimus on ette nähtud difuusse subependüümi hiiglasliku raku astrotsütoomi jaoks. |
Piloidset astrotsütoomi tuleks pärast sekkumist eemaldada magnetresonantstomograafia abil, et selgitada kasvajakoe radikaalse resektsiooni kvaliteeti. |
Glioblastoomis tuleks operatsioonijärgne ravi kombineerida (kiiritus + keemiaravi) temosolomiidi manustamisega. |
Anaplastilises astrotsütoomis pärast operatsiooni on näidatud kiiritusravi täiendava ravimiraviga. Kasutatakse lomustine, temosolomiidi. |
Anaplastilise oligodendroglioomi või oligoastrotsütoomiga patsiendid saavad pärast operatsiooni nii kiirguse kui ka keemiaravi (temosolomiid või PCV monoteraapia). |
Eakaid patsiente, kellel on ulatuslik kõrge pahaloomuline glioom, kiiritatakse hüpofraktsioonitud režiimis või viiakse läbi monoteraapia temosolomiidiga. |
Glioomi kordumise korral arutab kordusoperatsiooni ja sellele järgneva ravitaktika võimalust spetsialistide kastium. Kordumiste optimaalne raviskeem: uuesti operatsioon + süsteemne keemiaravi + korduv kiirgusega kokkupuude + palliatiivsed mõõtmed. Kui on olemas lokaliseeritud väiksemad kasvaja kasvu alad, võib kasutada radiosurgiat. |
Korduva glioomi kasvu jaoks valitud ravimid on temosolomiid ja bevatsizumab. |
Väga pahaloomuliste oligodendroglioomide ja anaplastiliste astrotsütoomide kordumine on näidustus temosolomiidi ravile. |
Pleomorfne ksaantoastrotsütoom eemaldatakse ilma kohustusliku adjuvandi keemiaravita. |
Glioomide üks eripära on nende ravi ja eemaldamise raskus. Kirurgi eesmärk on haigusseisundi kompensatsiooni saavutamiseks eemaldada võimalikult täielikult neoplasma kuded. Paljud patsiendid suudavad elukvaliteeti parandada ja seda pikendada, kuid väga pahaloomuliste kasvajate jaoks on prognoos endiselt ebasoodne: patoloogilise fookuse taaskäivituse tõenäosus on suurenenud.
Aju glioomi toitumine
Dieet pahaloomuliste kasvajatega patsientidele - oluline punkt, millele kahjuks paljud inimesed ei pööra palju tähelepanu. Samal ajal on tänu dieedi muutustele võimalik aeglustada glioomi arengut ning tugevdada ja raputada immuunsust.
Toitumismuutuste peamised valdkonnad:
- Metaboolsete protsesside normaliseerimine, immuunkaitse tugevdamine;
- Keha võõrutus;
- Energiapotentsiaali optimeerimine;
- Kõigi keha organite ja süsteemide normaalse toimimise tagamine nende jaoks nii keerulisel perioodil.
Vajalik on ratsionaalne ja tasakaalustatud dieet, kuna patsiendid, kellel on madala pahaloomuliste neoplasmide varajased staadiumid, ja glioblastoomi viimase etapiga patsiendid. Hoolikalt valitud dieet aitab kaasa üldise heaolu, kahjustatud kudede taastumisele, mis on eriti oluline tsütostaatilise ja kiiritusravi taustal. Toitumiskomponentide tasakaal ja korralikud metaboolsed protsessid takistavad nakkuslike fookuste moodustumist, blokeerivad põletikulisi reaktsioone, takistavad keha ammendumist.
Aju glioomi jaoks on soovitatav järgmised toidud ja joogid:
- Punased, kollased ja oranži värvi puu- ja köögiviljad (tomatid, virsikud, aprikoosid, porgandid, peet, peet, tsitrusviljad), mis sisaldavad karotenoide, mis kaitsevad terveid rakke kiiritusravi negatiivsete mõjude eest;
- Kapsas (lillkapsas, spargelkapsas, rooskapsas), redised, sinep ja muud taimsed tooted, mis sisaldavad indooli - aktiivset ainet, mis neutraliseerib kahjulikke toksilisi ja keemilisi tegureid;
- Rohelised (till, petersell, noor võilill- ja nõgeslehed, rabarber, arugula, spinat), rohelised herned ja spargel, spargli oad ja vetikad (merevetikad, spirulina, Chlorella);
- Roheline tee;
- Küüslauk, sibul, ananass, millel on kasvajavastane ja võõrutusvõime;
- Kliid, teraviljad, täisteraleib, idanenud kaunviljad, terad ja seemned;
- Tumedad viinamarjad, vaarikad, maasikad ja maasikad, mustikad, murakad, granaatõunad, sõstrad, mustad voogud, rowanberikad, mustikad, meripaukk, kirsid ja muid marjasid, mis sisaldavad looduslikke antioksüdante, mis vähendavad vabade radikaalide negatiivseid mõjusid, viiruste ja kartsiogeenide negatiivseid mõjusid;
- Madala rasvasisaldusega piimatooted.
Te ei tohiks seedesüsteemi ja kogu keha koormada raskete ja rasvaste toitudega. Kasulik on kasutada värskelt pigistatud omatehtud mahlasid, smuutisid, morsse. Nõudele tuleks lisada oomega-3 rasvhapete, näiteks kalaõli, linaseemneõli või linaseemnete allikad.
Parem on vältida suhkrut ja maiustusi. Kuid lusikatäis mett tassi veega ei tee haiget: mesilaste toodetel on väljendunud põletikuvastane, antioksüdant ja kasvajavastane toime. Ainus mee kasutamise vastunäidustus on tootele allergia.
Dieedist tuleks välistada:
- Liha, seapekk, lahti;
- Või, rasvased piimatooted;
- Suitsutatud liha, vorstid, konserveeritud liha ja kala;
- Alkohol mis tahes kujul;
- Maiustused, saiakesed, koogid ja saiad, kommid ja šokolaadid;
- Mugavus toidud, kiirtoit, suupisted;
- Praetud toidud.
Peaksite igapäevaselt tarbima piisavalt köögivilju, rohelisi, puuvilju ja puhast joogivett.
Keemiaravi ajal ja mõnda aega pärast seda peaksite juua omatehtud köögivilja- ja puuviljamahlasid, sööma omatehtud madala rasvasisaldusega kodujuustu, piima ja juustu. Oluline on juua palju vedelikke, pesta hambaid ja loputada suu sageli (umbes 4 korda päevas).
Optimaalsed söögid aju glioomihaigetele:
- Köögiviljade pajaroogad;
- Teraviljadest valmistatud lisandid ja supid (eelistatavalt tatar, kaerahelbed, riis, kuskuss, bulgur);
- Aurutatud juustukoogid, pudingid, pajaroogid;
- Hautatud ja küpsetatud köögiviljad;
- Hautid, köögiviljasupid, esimene ja teine roog kaunviljadest (sealhulgas soja), pâtés ja suffelid;
- Smuutid, roheline tee, kompotid ja morsse.
Ärahoidmine
Kui inimene juhib tervislikku eluviisi ja tema sugulaste seas ei olnud vähipatoloogia juhtumeid, on tal kõik võimalused mitte aju glioomi saada. Selliste kasvajate konkreetset ennetamist ei ole, seetõttu peetakse peamisi ennetuslikke punkte korralikuks toitumiseks, füüsiliseks aktiivsuseks, halbade harjumuste vältimiseks, töö- ja leibkondade ohtude puudumiseks.
Spetsialistid annavad mitmeid lihtsaid, kuid samas tõhusaid soovitusi:
- Joo rohkem puhast vett, vältige magustatud soodasid, pakendatud mahlasid, energiajooke ja alkoholi.
- Vältige töö- ja leibkondade ohte: vähem kokkupuudet kemikaalide, söövitavate lahuste ja vedelikega.
- Proovige toitu valmistada keetmise, hautamise, küpsetamise, kuid mitte praadimisega. Eelistage tervislikke ja kvaliteetseid omatehtud toite.
- Suur osa teie dieedist peaks olema taimsed toidud, sealhulgas rohelised, sõltumata aastaajast.
- Teine negatiivne tegur on ülekaaluline, millest tuleks lahti saada. Kaalukontroll on kogu keha tervise jaoks väga oluline.
- Taimeõlisid tuleks alati eelistada või ja seapeki kohal.
- Võimaluse korral on soovitav eelistada keskkonnasõbralikke tooteid, liha ilma hormoone, köögivilju ja puuvilju ilma nitraatide ja pestitsiidideta. Parem on punast liha täielikult vältida.
- Ärge võtke multivitamiinipreparaate ilma näidustusteta ja suurtes kogustes. Ärge võtke ravimeid ilma arsti retseptita: eneseravimine on sageli väga-väga ohtlik.
- Kui ilmnevad kahtlased sümptomid, on vaja külastada arsti, ootamata olukorra süvenemist, kahjulike mõjude ja tüsistuste tekkimist.
- Kõrge glükeemilise indeksiga maiustused ja toidud on dieedi ebasoovitav komponent.
- Mida varem inimene arstide juurde läheb, seda paremad tema ravivõimalused (ja see kehtib peaaegu iga haiguse, sealhulgas aju glioomi kohta).
Onkopatoloogia moodustumise vältimiseks vajate piisavalt aega magamiseks ja puhkamiseks, vältige alkohoolsete jookide liigset tarbimist, eelistage kvaliteetset looduslikku toitu, vähendada vidinate (eriti mobiiltelefonide) kasutamist.
Kasvajahaigused esinevad sageli eakatel ja vanadel inimestel. Seetõttu on oluline jälgida oma tervist juba noorelt ja mitte provotseerida patoloogilisi protsesse ebatervislike elustiilide ja ebatervislike harjumuste tõttu.
Onkoloogia täpsed algpõhjused pole veel selgitatud. Kuid teatud roll mängib muidugi ebasoodsaid töö- ja keskkonnatingimusi, kokkupuudet ioniseeriva ja elektromagnetilise kiirgusega, hormonaalsed muutused. Ärge püsige kaua ja regulaarselt päikese all, võimaldage äkilisi muutusi ümbritsevas temperatuuris, kuumeneda vannis või saunas, tehke sageli kuumade vannide või duššide.
Veel üks küsimus: kuidas vältida aju glioomi kordumist pärast selle edukat ravi? Neoplasmi kasvu kordumine on keeruline ja kahjuks sagedane komplikatsioon, mida on raske ette ennustada. Patsiente võib soovitada läbi viia regulaarselt ennetavaid uuringuid ja kontrollida, külastada onkoloogi ja osaleda arst vähemalt kaks korda aastas, tervislikku eluviisi, tervislikku ja looduslikku toitu, harjutada mõõdukat kehalist aktiivsust. Teine seisund on eluarmastus, tervislik optimism, positiivne suhtumine õnnestumisse igal juhul. See hõlmab ka sõbralikku õhkkonda perekonnas ning lähedaste inimeste tööl, kannatlikkust ja tingimusteta tuge.
Prognoos
Aju seisund ja glioomi omadused selle avastamise ajal mõjutavad ellujäämismäära sama palju kui manustatud ravi. Patsiendi ja tema vanuse rahuldav üldine tervis parandab prognoosi (prognoos on noortel patsientidel optimistlikum). Oluline näitaja on neoplasma histoloogiline pilt. Seega on madala kvaliteediga glioomidel parem prognoos kui anaplastiliste glioomide ja, veelgi enam-glioblastoomid (kõige ebasoodsamad kasvaja protsessid). Astrotsütoomidel on halvem prognoos kui oligodendroglioomidel.
Pahaloomulised astrotsütoomid reageerivad teraapiale halvasti ja nende elulemuse suhteliselt madal on kuus kuni viis aastat. Samal ajal on madala kvaliteediga glioomide eeldatav eluiga hinnanguliselt 1-10 aastat.
Pahaloomulised astrotsütoomid on sisuliselt ravimatud. Ravi suund hõlmab tavaliselt neuroloogiliste ilmingute (sealhulgas kognitiivse düsfunktsiooni) vähendamist ja eeldatava eluiga suurendamist, säilitades samas võimalikult kõrge elukvaliteedi. Sümptomaatilist ravi meelitatakse rehabilitatsioonimeetmete taustal. Samuti on oluline psühholoogi töö.
Viimase kümne aasta jooksul on teadlased teinud teatavaid edusamme ajukasvajate olemuse ja nende raviks. Haiguse prognoosi optimeerimiseks tuleks palju rohkem ära teha. Spetsialistide peamine ülesanne on täna järgmine: Aju glioomil peaks olema mitu skeemi probleemi tõhusaks kõrvaldamiseks korraga nii varajases kui ka järgnevas arenguetapis.

