Artikli meditsiiniline ekspert
Uued väljaanded
Inimese immuunpuudulikkuse viirus (HIV)
Viimati vaadatud: 04.07.2025

Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
Omandatud immuunpuudulikkuse sündroom identifitseeriti spetsiifilise haigusena 1981. aastal Ameerika Ühendriikides, kui mitmetel noortel tekkisid tõsised haigused, mille põhjustasid mikroorganismid, mis olid tervete inimeste jaoks mittepatogeensed või nõrgalt patogeensed. Patsientide immuunseisundi uuring näitas lümfotsüütide arvu järsku vähenemist üldiselt ja eriti T-abistajarakkude arvu järsku vähenemist. Seda seisundit nimetati AIDS-iks (omandatud immuunpuudulikkuse sündroom). Nakatumisviis (seksuaalne kontakt, vere ja selle preparaatide kaudu) viitas haiguse nakkavale olemusele.
AIDSi tekitaja avastas 1983. aastal iseseisvalt prantslane L. Montagnier, kes nimetas selle LAV-lümfoadenopaatiaga seotud viiruseks (Lymphodenopathy Associated Virus), kuna ta leidis selle lümfadenopaatiaga patsiendilt; ja ameeriklane R. Gallo, kes nimetas viiruse HTLV-III-ks (inimese T-lümfotroopne viirus III): ta oli varem avastanud lümfotroopsed viirused I ja II.
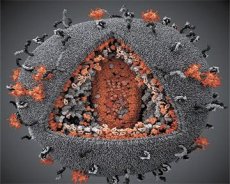
LAV- ja HTLV-III viiruste omaduste võrdlus näitas nende identsust, seega segaduse vältimiseks nimetati viirus 1986. aastal HIV-ks (inimese immuunpuudulikkuse viirus ehk HIV). HIV on sfäärilise kujuga, läbimõõduga 110 nm. Viiruse ümbris on polüeedri kujuline, koosnedes 12 viisnurgast ja 20 kuusnurgast. Iga kuusnurga keskel ja nurkades asub glükosüülitud valgu gpl20 molekul (number 120 näitab valgu molekulmassi kilodaltonites). Viriooni pinnal paikneb kokku 72 gpl20 molekuli omapäraste ogade kujul, millest igaüks on seotud membraanisisese valgu gp41-ga. Need valgud moodustavad koos topeltlipiidkihiga viriooni superkapsiidi (membraani).
Valgud gpl20 ja gp41 moodustuvad Env eellasvalgu lõikamisel rakulise proteaasi poolt. Valk gp41 moodustab oga "tüve", seondudes oma tsütoplasmaatilise domeeniga maatriksvalguga p17MA, mis asub otse ümbrise all. p17 molekulid interakteeruvad viriooni küpsemise ajal, moodustades ümbrise all ikosaeedri.
Viriooni keskosas moodustab valk p24 koonusekujulise kapsiidi. Kapsiidi kitsenenud osa on ühendatud virioonimembraaniga rb valgu osalusel. Kapsiidi sees on kaks identset viirusliku genoomse RNA molekuli. Need on oma 5'-otsaga ühendatud nukleokapsiidvalguga p7NC. See valk on huvitav selle poolest, et sellel on kaks tsüsteiini- ja histidiinirikast aminohappejääki (motiivi), mis sisaldavad Zn-aatomit – neid nimetatakse "tsinksõrmedeks", kuna need püüavad kinni genoomse RNA molekule, et need moodustuvatesse virionidesse lisada. Kapsiid sisaldab ka kolme ensüümi. Revertaas (RT) ehk pol-kompleks hõlmab pöördtranskriptaasi, RNase H-d ja DNA-sõltuvat DNA polümeraasi. Revertaas esineb heterodimeerina p66/p51. Proteaas (PR) - p10 algatab ja viib läbi viriooni küpsemise protsessi. Integraas (IN) - p31 ehk endonukleaas tagab proviraalse DNA lisamise peremeesraku genoomi. Kapsiid sisaldab ka praimer-RNA molekuli (tRNAl"3).
Rakus olev RNA genoom muundatakse pöördtranskriptaasi abil DNA genoomiks (DNA proviiruseks), mis koosneb 9283 nukleotiidipaarist. Vasakult ja paremalt piiravad seda nn pikad terminaalsed kordused ehk LTR-id: vasakul S'-LTR ja paremal 3'-LTR. LTR-id sisaldavad igaüks 638 nukleotiidipaari.
HIV genoom koosneb 9 geenist, millest mõned kattuvad otstes (neil on mitu lugemisraami) ja neil on eksonintronstruktuur. Nad kontrollivad 9 struktuurvalgu ja 6 regulatiivse valgu sünteesi.
LTR-ide tähtsus viiruse genoomi jaoks seisneb selles, et need sisaldavad järgmisi regulatiivseid elemente, mis kontrollivad selle toimimist:
- transkriptsioonisignaal (promootori piirkond);
- polü-A liitumissignaal;
- piiramissignaal;
- integratsioonisignaal;
- positiivne regulatsioonisignaal (TAR TAT valgu jaoks);
- negatiivne regulatiivne element (NRE NEF valgu jaoks);
- 3'-otsas olev koht praimer-RNA (tRNA™3) kinnituskohaks miinus-ahelalise DNA sünteesiks; LTR-i 5'-otsas olev signaal, mis toimib praimerina pluss-ahelalise DNA sünteesiks.
Lisaks sisaldab LTR elemente, mis on seotud mRNA splaissingu regulatsiooniga ja vRNA molekulide pakkimisega kapsiidi (Psi element). Lõpuks, genoomi transkriptsiooni käigus moodustuvad pikkades mRNA-des REV valgu jaoks kaks signaali, mis lülitavad valgusünteesi: CAR - regulatiivsete valkude jaoks ja CRS - struktuurvalkude jaoks. Kui REV valk seondub CAR-iga, sünteesitakse struktuurvalgud; kui see puudub, sünteesitakse ainult regulatiivsed valgud.
Viiruse genoomi toimimise reguleerimisel mängivad eriti olulist rolli järgmised regulatiivsed geenid ja nende valgud:
- TAT-valk, mis teostab viiruse replikatsiooni positiivset kontrolli ja toimib TAR-i regulatiivse piirkonna kaudu;
- NEV ja VPU valgud, mis avaldavad NRE piirkonna kaudu replikatsiooni negatiivset kontrolli;
- REV-valk, mis teostab positiivse-negatiivset kontrolli. REV-valk kontrollib gag-, pol- ja env-geenide tööd ning teostab splaissingu negatiivset regulatsiooni.
Seega on HIV replikatsioon kolmekordse kontrolli all - positiivne, negatiivne ja positiivne-negatiivne.
VIF-valk määrab äsjasünteesitud viiruse nakkavuse. See on seotud p24 kapsiidvalguga ja esineb virionis 60 molekuli ulatuses. NEF-valku esindab virionis väike arv molekule (5–10), mis on võimalik, et seotud ümbrisega.
VPR-valk pärsib rakutsüklit G2-faasis, osaleb preintegratsioonikomplekside transpordis rakutuuma, aktiveerib mõningaid viirus- ja rakugeene ning suurendab viiruse replikatsiooni efektiivsust monotsüütides ja makrofaagides. VPR-, TAT-, REV- ja VPU-valkude asukoht virioonis pole kindlaks tehtud.
Lisaks oma valkudele võib viriooni membraan sisaldada mõningaid peremeesraku valke. VPU ja VPR valgud osalevad viiruse paljunemise regulatsioonis.
Inimese immuunpuudulikkuse viiruse (HIV) antigeensed variandid
Inimese immuunpuudulikkuse viirus (HIV) on väga varieeruv. Isegi ühe patsiendi kehast saab eraldada viirusetüvesid, mis erinevad oluliselt antigeensete omaduste poolest. Sellist varieeruvust soodustab CD4+ rakkude intensiivne hävimine ja võimas antikehade vastus HIV-nakkusele. Lääne-Aafrika patsientidelt on eraldatud uus HIV vorm, HIV-2, mis on bioloogiliselt lähedane HIV-1-le, kuid immunoloogiliselt sellest erinev. Nende viiruste genoomide primaarstruktuuri homoloogia on 42%. HIV-2 DNA proviirus sisaldab 9671 bp ja selle LTR on 854 bp. HIV-2 eraldati hiljem ka teistes maailma piirkondades. HIV-1 ja HIV-2 vahel ristimmuunsust ei esine. HIV-1-l on teada kaks suurt vormi: O (Outlier) ja M (Major), viimane jaguneb 10 alatüübiks (AJ). Venemaal levib kaheksa alatüüpi (AH).
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
HIV-i ja raku interaktsiooni mehhanism
Pärast organismi tungimist ründab viirus esmalt rakke, mis sisaldavad talle spetsiifilist CD4-retseptorit. See retseptor esineb suures koguses T-abistajarakkudes, väiksemas koguses makrofaagides ja monotsüütides ning T-abistajad on viiruse suhtes eriti tundlikud.
Inimese immuunpuudulikkuse viirus (HIV) tunneb CD4 retseptoreid ära oma gpl20 valgu abil. HIV interaktsiooniprotsess rakuga toimub järgmise skeemi järgi: retseptori vahendatud adsorptsioon -> kaetud süvend -> kaetud vesiikul -> lüsosoom. Selles sulandub virionmembraan lüsosoomi membraaniga ja superkapsiidist vabanenud nukleokapsiid siseneb tsütoplasmasse; teel tuuma see hävib ning vabanevad genoomne RNA ja sellega seotud põhikomponendid. Seejärel sünteesib pöördtranskriptaas virioni RNA-l DNA miinusahela, seejärel RNaas H hävitab virioni RNA ja viiruse DNA polümeraas sünteesib DNA plussahela. DNA proviiruse otstes moodustuvad 5'-LTR ja 3'-LTR. DNA proviirus võib tuumas mõnda aega inaktiivsel kujul püsida, kuid varem või hiljem integreerub see oma integraasi abil sihtraku kromosoomi. Selles jääb proviirus inaktiivseks, kuni antud T-lümfotsüüt aktiveeritakse mikroobsete antigeenide või teiste immunokompetentsete rakkude poolt. Rakulise DNA transkriptsiooni aktiveerimist reguleerib spetsiaalne tuumafaktor (NF-kB). See on DNA-d siduv valk ja seda toodetakse suurtes kogustes T-lümfotsüütide ja monotsüütide aktiveerimise ja proliferatsiooni käigus. See valk seondub teatud rakulise DNA järjestuste ja DNA proviiruse sarnaste LTR-järjestustega ning indutseerib nii rakulise DNA kui ka DNA proviiruse transkriptsiooni. DNA proviiruse transkriptsiooni indutseerides viib see läbi viiruse ülemineku inaktiivsest olekust aktiivsesse olekusse ja vastavalt püsivast infektsioonist produktiivsesse olekusse. Proviirus võib jääda inaktiivsesse olekusse väga pikaks ajaks. Viiruse aktiveerimine on kriitiline hetk selle interaktsioonis rakuga.
Alates hetkest, mil viirus tungib rakku, algab HIV-nakkuse periood – viiruse kandja seisund, mis võib kesta 10 aastat või kauem; ja hetkest, mil viirus aktiveerub, algab haigus – AIDS. Oma regulatiivsete geenide ja nende saaduste abil hakkab viirus aktiivselt paljunema. TAT-valk võib viiruse paljunemiskiirust 1000 korda suurendada. Viiruse transkriptsioon on keeruline. See hõlmab nii täispika kui ka subgenoomse mRNA moodustumist, mRNA splaissingut ning seejärel struktuur- ja regulatiivsete valkude sünteesi.
Struktuurvalkude süntees toimub järgmiselt. Esmalt sünteesitakse Pr55Gag eellasvalk (valk molekulmassiga 55 kDa). See sisaldab 4 peamist domeeni: maatriks (MA), kapsiid (CA), nukleokapsiid (NC) ja rb domeen, millest Pr55Gag lõikamise tulemusena viirusproteaasi poolt (see lõigatakse ise teisest eellasvalgust, Gag-Pol) moodustuvad vastavalt struktuurvalgud p17, p24, p7 ja rb. Pr55Gag polüproteiini moodustumine on viirusosakeste moodustumise peamine tingimus. Just see valk määrab virioni morfogeneesi programmi. See hõlmab järjestikku Gag polüproteiini transpordi etappe plasmamembraanile, interaktsiooni sellega ja valk-valk interaktsioone viirusosakese moodustumise ja selle pungumise ajal. Pr55Gag sünteesitakse vabadel polüribosoomidel; valgumolekulid transporditakse membraanile, kus nad ankurdatakse oma hüdrofoobsete piirkondade abil. CA domeen mängib peamist rolli Gag valgu natiivse konformatsiooni loomisel. NC-domeen tagab (oma "tsinksõrmede" abil) kahe genoomse RNA molekuli kaasamise moodustuva viirusosakese koostisse. Polüproteiini molekul dimeriseerub esialgu maatriksdomeenide interaktsiooni tõttu. Seejärel ühinevad dimeerid CA ja NC domeenide interaktsiooni tulemusel heksameerseteks (6-ühikulisteks) kompleksideks. Lõpuks moodustavad heksameerid oma külgpindadel ühinedes ebaküpsed sfäärilised virionid, mille sees asub genoomne viirusRNA, mis on NC domeeni poolt kinni püütud.
Teine eellasvalk, Prl60Gag-Pol (valk molekulmassiga 160 kDa), sünteesitakse ribosoomi poolt raaminihke tulemusena gag-geeni 3'-otsa translatsiooni ajal piirkonnas, mis asub vahetult rb-valku kodeeriva piirkonna ülesvoolu. See Gag-Pol polüvalk sisaldab mittetäielikku Gag-valgu järjestust (1-423 aminohapet) ja Pol-järjestusi, mis hõlmavad PR-, RT- ja IN-domeene. Gag-Pol polüvalgu molekulid sünteesitakse samuti vabadel polüribosoomidel ja transporditakse plasmamembraanile. Prl60Gagpol polüvalk sisaldab kõiki Gag-polüproteiinile omaseid molekulidevahelisi interaktsioonikohti ja membraaniga seondumise kohti. Seetõttu sulanduvad Gag-Pol polüvalgu molekulid membraaniga ja koos Gag-molekulidega kaasatakse moodustuvate virionide hulka, mille tulemuseks on aktiivse proteaasi ilmumine ja virioni küpsemisprotsessi algus. HIV-1 proteaas on väga aktiivne ainult dimeeri kujul, seega on Prl60Gag-Polist iseeneslikuks ekstsisiooniks vajalik nende molekulide dimeriseerumine. Viriooni küpsemine seisneb selles, et vabanenud aktiivne proteaas lõikab prl60Gag-Polit ja Gag55-d nende poolt äratuntavates kohtades; moodustuvad valgud p17, p24, p7, p6, revertase, integraas ja toimub nende seondumine viiruse struktuuriga.
Env valk sünteesitakse endoplasmaatilise retiikulumi membraanidega seotud ribosoomides, seejärel glükosüülitakse, lõigatakse rakulise proteaasi abil gp120-ks ja gp41-ks ning transporditakse raku pinnale. Sel juhul tungib gp41 läbi membraani ja seondub membraani sisepinnaga seotud Gag-valgu molekuli maatriksdomeenidega. See seos säilib küpses virioonis.
Seega koosneb viirusosakeste kokkupanek prekursorvalkude ja nendega seotud RNA molekulide agregatsioonist peremeesraku plasmamembraanil, ebaküpsete virionide moodustumisest ja nende vabanemisest pungumise teel raku pinnalt. Pungumise ajal ümbritseb virion end rakumembraaniga, millesse kinnistuvad gp41 ja gp120 molekulid. Pungumise ajal või võimalik, et pärast virionide vabanemist toimub nende küpsemine, mis toimub viirusproteaasi abil ja seisneb prekursorvalkude Pr55Gag ja Prl60Gag-Pol proteolüütilises lõikamises küpse viiruse valkudeks ja nende ühendamises teatud struktuurikompleksideks. Viiruse morfogeneesi protsessides mängib juhtivat rolli prekursorpolüproteiin Pr55Gag, mis organiseerib ja koondab ebaküpset virioni; selle küpsemise protsessi viib lõpule spetsiifiline viirusproteaas.
Immuunpuudulikkuse põhjused
Üks peamisi HIV-nakkuse immuunpuudulikkuse põhjuseid on T-abistajarakkude massiline surm. See toimub järgmiste sündmuste tagajärjel. Esiteks surevad viirusega nakatunud T-abistajad apoptoosi tõttu. Arvatakse, et AIDS-i patsientidel on viiruse replikatsioon, apoptoos ja T-abistajarakkude arvu vähenemine omavahel seotud. Teiseks tunnevad T-tapjad ära ja hävitavad viirusega nakatunud või adsorbeeritud gpl20 molekule kandvaid T-rakke, samuti viirusega nakatunud ja viirusega nakatumata T-abistajaid, mis moodustavad mitmekümnest rakust koosnevaid sümplaste (süntsüüte) (mõned neist surevad neis viiruste paljunemise tagajärjel). Suure hulga T-abistajarakkude hävimise tagajärjel väheneb B-lümfotsüütides membraaniretseptorite ekspressioon interleukiin-2 suhtes, häirub erinevate interleukiinide (B-lümfotsüütide kasvufaktorid ja diferentseerumine - IL-4, IL-5, IL-6 jne) süntees, mille tulemuseks on T-tapjarakkude süsteemi funktsiooni häire. Komplemendi ja makrofaagide süsteemide aktiivsus on pärsitud. Viirusega nakatunud makrofaagid ja monotsüüdid ei sure pikka aega, kuid nad ei ole võimelised viirust organismist eemaldama. Lõpuks, tänu gpl20 struktuurilisele ja antigeensele sarnasusele mõnede keha epiteelirakkude retseptoritega (sealhulgas trofoblastide retseptoritega, mis vahendavad HIV siirdamisülekannet), sünteesitakse laia toimespektriga retseptorivastaseid antikehi. Sellised antikehad on võimelised blokeerima mitmesuguseid rakulisi retseptoreid ja raskendama haiguse kulgu autoimmuunhaiguste korral. HIV-nakkuse tagajärjeks on immuunsüsteemi kõigi peamiste lülide kaotus. Sellised patsiendid muutuvad kaitsetuks paljude mikroorganismide vastu. See viib oportunistlike infektsioonide ja kasvajate tekkeni. HIV-nakkusega patsientidel suureneb risk haigestuda vähemalt kolme tüüpi vähki: Kaposi sarkoom; kartsinoom (sealhulgas nahavähk); B-rakuline lümfoom, mis tekib B-lümfotsüütide pahaloomulise transformatsiooni tõttu. HIV ei ole aga mitte ainult lümfotsütotroopne, vaid ka neurotroopne. See tungib kesknärvisüsteemi rakkudesse (astrotsüütidesse) nii retseptorvahendatud endotsütoosi teel kui ka viirusega nakatunud lümfoblastide fagotsütoosi teel astrotsüütide poolt. Kui viirus interakteerub astrotsüütidega, tekivad ka sümplastid, mis hõlbustavad patogeeni levikut rakkudevaheliste kanalite kaudu. Viirus võib makrofaagides ja monotsüütides pikka aega püsida, seega toimivad need selle reservuaarina ja levitajana organismis, olles võimelised tungima kõikidesse kudedesse. Nakatunud makrofaagidel on suur roll HIV-i sissetoomisel kesknärvisüsteemi ja selle kahjustuses. 10% patsientidest on primaarsed kliinilised sündroomid seotud kesknärvisüsteemi kahjustusega ja avalduvad dementsusena. Seega iseloomustavad HIV-i nakatunud inimesi 3 haiguste rühma - oportunistlikud infektsioonid,kasvajahaigused ja kesknärvisüsteemi kahjustused.
HIV-nakkuse epidemioloogia
HIV-nakkuse allikaks on ainult inimene – haige inimene või viiruse kandja. Inimese immuunpuudulikkuse viirust (HIV) leidub veres, spermas, emakakaelavedelikus; imetavatel emadel rinnapiimas. Nakatumine toimub seksuaalsel teel, vere ja sellest valmistatud vere kaudu, samuti emalt lapsele enne sünnitust, sünnituse ajal ja pärast sünnitust. Toidu, jookide ja putukahammustuste kaudu viirusega nakatumise juhtumeid ei ole teada.
Narkosõltuvus aitab kaasa AIDSi levikule. HIV-i esinemissagedus kasvab iga aastaga. WHO andmetel nakatus aastatel 1980–2000 HIV-i 58 miljonit inimest. Ainuüksi 2000. aastal nakatus kogu maailmas 5,3 miljonit inimest ja AIDSi tõttu suri 3 miljonit inimest. 1. jaanuari 2004. aasta seisuga oli Venemaal registreeritud 264 tuhat HIV-positiivset inimest. Pooled HIV-positiivsetest inimestest surevad 11–12 aasta jooksul alates nakatumise hetkest. 2004. aasta alguses elas Venemaa 100 000 kodanikust umbes 180 HIV-nakkuse diagnoosiga. Prognoositakse, et selle haigestumuse taseme korral on Venemaal 2012. aastaks HIV-nakatunud inimeste koguarv 2,5–3 miljonit inimest. HIV-nakkuse vastase võitluse keerukus sõltub mitmest põhjusest: esiteks puuduvad tõhusad meetodid selle raviks ja spetsiifiliseks ennetamiseks; teiseks võib HIV-nakkuse inkubatsiooniperiood ületada 10 aastat. Selle kestus sõltub T-lümfotsüüdi ja selle kromosoomis sisalduva DNA proviiruse aktiveerimise hetkest. Pole veel selge, kas kõik viirusega nakatunud on määratud AIDS-ile või on viiruse pikaajaline kandmine ilma haiguseta võimalik (mis tundub ebatõenäoline). Lõpuks on olemas mitu inimese immuunpuudulikkuse viirust (HIV-1, HIV-2), mille antigeensed erinevused takistavad ristimmuunsuse teket. Ahvide immuunpuudulikkuse viiruse (SIV) avastamine heitis valgust HIV päritolu küsimusele. SIV on oma genoomi korralduse poolest sarnane HIV-ga, kuid erineb oluliselt oma nukleotiidjärjestuse poolest. HIV-2 asub oma seroloogiliste omaduste poolest HIV-1 ja SIV vahepealsel positsioonil ning on oma nukleotiidjärjestuse poolest SIV-le lähemal. Sellega seoses pakkus V. M. Ždanov välja, et HIV-1, HIV-2 ja SIV viirused pärinevad ühiselt esivanemalt. R. Gallo sõnul on võimalik, et üks SIV-idest sattus kuidagi inimkehasse, kus see läbis rea mutatsioone, mille tulemusel tekkisid HIV-1, HIV-2 ja selle teised vormid.
HIV-nakkuse sümptomid
Inimese immuunpuudulikkuse viirusel on mõned tunnused, mis määravad suuresti haiguse patogeneesi. Viirusel on väga kõrge paljunemiskiirus, mille määravad selle regulatiivsed elemendid (aktiivses staadiumis sünteesitakse kuni 5000 virioni 5 minuti jooksul). Fusioonvalgu (gp41) olemasolu tõttu indutseerib viirus nakatunud ja nakatumata T-abistajarakkude ühinemise tõttu ulatuslike süntsütiaalstruktuuride moodustumist, mille tulemuseks on nende massiline surm. Suurtes kogustes moodustunud gpl20 valgu molekulid ringlevad vabalt veres ja seonduvad nakatumata T-abistajarakkude retseptoritega, mille tulemusena T-tapjad neid samuti ära tunnevad ja hävitavad. Viirus võib levida rakkudevaheliste kanalite kaudu rakust rakku, sellisel juhul muutub see antikehadele halvasti ligipääsetavaks.
HIV-nakkuse kliinilised kriteeriumid
Täiskasvanutel diagnoositakse HIV-nakkus, kui neil esineb vähemalt kaks tõsist sümptomit koos vähemalt ühe kerge sümptomiga ja puuduvad muud teadaolevad immuunpuudulikkuse põhjused (vähk, kaasasündinud immuunpuudulikkus, raske nälg jne). Tõsised sümptomid on järgmised:
- kaalulangus 10% või rohkem;
- pikaajaline palavikuline seisund, vahelduv või pidev;
- krooniline kõhulahtisus.
Väiksemad sümptomid: püsiv köha, generaliseerunud dermatiit, korduv vöötohatis, suuõõne ja neelu kandidoos, krooniline herpes simplex, generaliseerunud lümfadenopaatia. AIDSi diagnoos pannakse ainult Kaposi sarkoomi, krüptokokkmeningiidi ja pneumotsüstilise kopsupõletiku esinemisel. Haiguse kliinilist pilti mõjutab kaasnev oportunistlik infektsioon.
Inimese immuunpuudulikkuse viiruse (HIV) kultiveerimise meetodid
HIV-1 ja HIV-2 saab kultiveerida ainult ühe TCV4 lümfotsüütide klooni - H9 - rakkudes, mis on saadud leukeemilistest TCV4 lümfotsüütidest. Nendel eesmärkidel saab kasutada ka astrotsüütide rakkude monokihilisi kultuure, milles HIV-1 paljuneb hästi. Šimpansid on loomade seas HIV-1 suhtes vastuvõtlikud.
Viiruse resistentsus väliskeskkonnas on madal. See sureb päikesevalguse ja UV-kiirguse mõjul, hävib temperatuuril 80 °C 30 minuti jooksul, tavaliste desinfitseerimisvahenditega töötlemisel - 20-30 minuti jooksul. Viirust sisaldava materjali desinfitseerimiseks on vaja kasutada mükobakteritsiidseid desinfitseerimisvahendeid, kuna need on tõhusad kõige resistentsemate mikroorganismide vastu.
HIV-nakkuse laboratoorne diagnostika
Viiruse kandluse ja HIV-nakkuse diagnoosimise peamine meetod on ensüümimmunoanalüüs. Kuna gpl20-l on aga struktuuriline ja antigeeniline sarnasus mõnede inimrakkude retseptoritega, sealhulgas retseptoritega, mis transpordivad immunoglobuliine läbi limaskestade epiteelirakkude, võivad organismis ilmneda gpl20-vastaste antikehadega seotud antikehad. Sellisel juhul võivad ELISA tulemused olla valepositiivsed. Seetõttu analüüsitakse kõiki positiivselt reageerivaid uuritavate seerumeid täiendavalt immunoblotmeetodi ehk Western blot'i abil. See meetod põhineb uuritavate antikehade identifitseerimisel pärast nende elektroforeetilist eraldamist ja järgnevat testimist märgistatud liigivastaste antikehadega. Viroloogilist meetodit kasutatakse harva viiruse kultiveerimise keerukuse tõttu. H9 lümfotsüütide klooni kasutatakse viirusantigeenide saamiseks - diagnostiliste testisüsteemide vajalikeks komponentideks. CPR-meetod võimaldab viirust tuvastada vireemia varases staadiumis.
HIV-nakkuse ravi
On vaja leida või sünteesida ravimeid, mis tõhusalt pärsivad pöördtranskriptaasi (revertaasi) või viirusproteaasi aktiivsust. Need takistaksid DNA proviiruse teket ja (või) pärsiksid viiruse rakusisest paljunemist. HIV-nakkusega patsientide ravimise tänapäevane strateegia põhineb viirusproteaasi (üks ravimitest) ja revertaasi (2 erinevat ravimit) pärssivate ravimite kombineeritud kasutamisel - kombineeritud (kolmekordne) ravi. Venemaal on HIV-nakkusega patsientide raviks soovitatav kahe kodumaise ravimi kombineeritud kasutamine: fosfasiid ja kriksivaan, mis pärsivad spetsiifiliselt HIV-i paljunemist paljunemise varases ja hilises staadiumis, eriti asidotümidiini vähenenud aktiivsuse korral.
Spetsiifilise profülaktika probleem seisneb vajaduses luua vaktsiin, mis tagaks viirusespetsiifilistel tsütotoksilistel lümfotsüütidel põhineva efektiivse raku vahendatud immuunsuse tekke ilma antikehade olulise tootmiseta. Sellise immuunsuse tagavad Thl abistajad. On võimalik, et antikehad, sealhulgas viirust neutraliseerivad, ei ole mitte ainult HIV-nakkuse pärssimisel ebaefektiivsed, vaid kõrgel tasemel pärsivad nad ka raku vahendatud immuunsust. Seetõttu peab HIV-vastane vaktsiin vastama esiteks kahele peamisele nõudele: a) olema täiesti ohutu ja b) stimuleerima T-tsütotoksiliste lümfotsüütide aktiivsust. Uuritakse erinevate vaktsiinivariantide efektiivsust, mis on saadud tapetud (inaktiveeritud) viirustest ja individuaalsetest antigeenidest, millel on kõrged kaitseomadused. Selliseid antigeene saab kas virionidest endist eraldada või keemiliselt sünteesida. On välja pakutud geenitehnoloogia meetoditel loodud vaktsiin. See on rekombinantne vaktsiiniaviirus, mis kannab HIV-geene, mis vastutavad tugevate immunogeensete omadustega antigeenide sünteesi eest. Nende vaktsiinide efektiivsuse küsimus nõuab HIV-nakkuse pika inkubatsiooniperioodi ja patogeeni suure varieeruvuse tõttu märkimisväärset aega. HIV-vastase ülitõhusa vaktsiini loomine on kiireloomuline põhiprobleem.

