Artikli meditsiiniline ekspert
Uued väljaanded
Subhondraalse luu muutuste roll osteoartriidi patogeneesis
Viimati vaadatud: 04.07.2025

Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
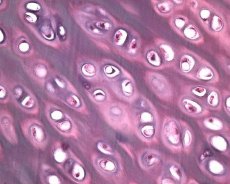
Lisaks liigesekõhre degeneratsioonile osaleb osteoartroosi patoloogilises protsessis ka alusluukude. Eeldatakse, et subhondraalse plaadi paksenemine aitab kaasa osteoartroosi progresseerumisele. Osteoartroosi progresseerumisel laguneb mehaanilisele ja keemilisele stressile allutatud liigesekõhre aeglaselt kõhre katabolismi ja reparatsiooni protsesside tasakaalustamatuse tõttu. Eelkõige aitab kehakaalu "kandvate" liigeste mehaaniline stress kaasa suure hulga mikropragude tekkele subhondraalses plaadis ja kõhres. Liigesekõhre lagunemisel subhondraalse luu skleroosi progresseerumisel suureneb luukoe jäikus, mis omakorda aitab kaasa liigesekõhre struktuuri edasisele häirdumisele. Küsimus subhondraalse luu muutuste primaarsest või sekundaarsest olemusest osteoartroosi korral jääb aga lahendamata.
Kuni viimase ajani peeti osteoartroosiga patsientidel subhondraalse luu käsnja aine radiograafiliselt tuvastatavaid muutusi, nagu skleroos või tsüstide moodustumine, sekundaarseteks. Kliiniliste ja eksperimentaalsete uuringute tulemused näitavad aga subhondraalse luu võimalikku initsieerivat rolli osteoartroosi patogeneesis. Üks võimalikest mehhanismidest on subhondraalse luu jäikusgradiendi järsk suurenemine, kuna aluskõhrekoe terviklikkus sõltub selle luu "voodi" mehaanilistest omadustest. Primaatidega läbi viidud uuringud on näidanud, et subhondraalse luu muutused võivad eelneda liigesekõhre muutustele. Osteoartroosi loommudelites ja kliinilistes uuringutes ilmnenud tõendid selle hüpoteesi poolt ja vastu on arutelu ainult süvendanud. Subhondraalse luu trabekulite paksenemisega ei kaasne alati luu mineralisatsiooni suurenemine või pigem osteoidi mahu suurenemine. See ebanormaalse mineralisatsiooni märk näitab, et luu remodelleerimise regulatsiooni häire on osteoartriidi lahutamatu osa ja toetab ka luurakkude defekti kontseptsiooni osteoartriidi korral. J. Dequekeri töörühm (1989) peab viimast "üldise metaboolse luuhaiguse" vormiks.
Luukoe uueneb pidevalt. See dünaamiline protsess, mida nimetatakse luu remodelleerumiseks, on keeruline resorptsiooni ja mineralisatsiooni jada. Osteoklastid resorbeerivad luukudet ja osteoblastid sekreteerivad valke, mis moodustavad mineraliseerumise peamise orgaanilise komponendi. Luukoe moodustumine ja resorptsioon ei toimu kogu skeletis juhuslikult; see on programmeeritud protsess, mis toimub skeleti erinevates piirkondades, mida nimetatakse luu remodelleerumisüksusteks. Tsükli alguses ilmuvad osteoklastid inaktiivsele pinnale; 2 nädala jooksul moodustavad nad tunneli kortikaalses luus või lünga trabekulaarse luu pinnal. Uute luu remodelleerumisüksuste aktiveerimise sagedus määrab luu uuenemise ulatuse. Tervel noorel inimesel on luu moodustumise ja resorptsiooni protsessid tasakaalus ning säilib normaalne luumass. Luukoe resorptsiooni hormonaalses regulatsioonis osalevad vähemalt PTH ja PGE2 mitte ainult osteoklastid , vaid ka osteoblastid, kuna nende hormoonide mõjul vabanevad osteoklastide poolt luu resorptsiooni stimuleerivad faktorid. Praegu on teada enam kui 12 luukoe kasvu lokaalset ja süsteemset regulaatorit, mis mõjutavad selle ümberkujunemist, eelkõige PTH, 1,25(OH)2D3 ,kaltsitoniin, kasvuhormoon, glükokortikoidid, kilpnäärmehormoonid, insuliin, IGF (1 ja 2), östrogeenid, PGE2 , androgeenid.
Luurakud vabastavad mitmeid valke ja tsütokiine, mis teostavad endokriinset regulatsiooni ja signaaliülekannet. Osteoblastide poolt toodetavate valkude hulka kuuluvad luu maatriksi valgud, nagu kollageen, osteopontiin, osteokaltsiin, luu sialoproteiinid. Lisaks vabastavad need rakud nii aktiivses kui ka latentse vormis proteaase, mis osalevad luukoe ümberehituse protsessis - MMP-sid, mis on plasminogeeni aktivaatori (PA)/plasmiini süsteemi komponendid. Osteoblastide poolt vabastatavad tsütokiinid võivad toimida nii autokriinsete mehhanismide kui ka parakriinsete radade kaudu kohalikele rakkudele (teistele osteoblastidele, osteoklastidele).
Pole veel teada, kas neid signaale reguleerib mehaaniline stress või muud mehaanilise stressi poolt esile kutsutud keemilised signaalid. Siiski on teada, et korduv mehaaniline stress põhjustab luurakkude ja/või valkude lokaalset proliferatsiooni. In vivo võib mehaaniline koormus aktiveerida osteoblaste, suurendada tsükliliste nukleotiidide taset, prostaglandiini tootmist ja põhjustada luu remodelleerimisega seotud morfoloogilisi muutusi. In vitro põhjustab mehaaniline stress osteoblastide kultuuride proliferatsiooni, osteoidide moodustumise ja mineralisatsiooniga seotud luuvalkude mRNA ekspressiooni, lokaalsete kasvufaktorite nagu IGF-1 ja IGF-2 ning adhesioonimolekulide vabanemist. Mehaanilise stressi signaali edastamine võib toimuda mehaanosensitiivsete ioonkanalite kaudu.
Osteoartroosi korral on kaudseid tõendeid osteoblastide düsfunktsiooni kohta. G. Gevers ja J. Dequeker (1987) näitasid käte osteoartroosiga naistel seerumi osteokaltsiini taseme tõusu, samuti kortikaalsete luueksplantaatide puhul, mis viitab sellele, et luupatoloogia võib olla osa osteoartroosist. Lahkamisel ilmnes lisaks subhondraalse luu paksenemisele ka reieluupea ebanormaalselt madal mineralisatsioon. Kirurgiliselt esilekutsutud osteoartroosiga merisigadel näitas kompuutertomograafia subhondraalse tsooni luufraktsiooni olulist paksenemist. Kollageeni ja mittekollageeni (osteokaltsiini jne) valkude tasakaalustamatus võib viia luumahu suurenemiseni, kuid ei mõjuta selle mineraalset tihedust. M. Shimizu jt (1993) sõnul on liigesekõhre degeneratiivsete muutuste progresseerumine seotud subhondraalse luu intensiivsema ümberkujunemise ja selle jäikuse suurenemisega, mis viitab samuti luukoe rakkude defektile osteoartroosi korral. B. Lee ja M. Aspdeni (1997) pakutud hüpoteesi kohaselt võib defektsete luurakkude vohamine viia luukoe jäikuse suurenemiseni, kuid ei põhjusta selle mineraalse tiheduse suurenemist.
CI Westacott jt (1997) püstitasid hüpoteesi, et ebanormaalsed osteoblastid mõjutavad otseselt kõhre ainevahetust. Osteoartriidiga patsientidelt pärit osteoblastide kultiveerimisel koos liigesehaigusteta inimeste kondrotsüütidega täheldasid autorid in vitro glükosaminoglükaanide vabanemise olulist muutust normaalse kõhrekoe poolt, kuid tsütokiinide vabanemise tase jäi samaks. G. Hilal jt (1998) näitasid, et osteoartriidiga patsientide subhondraalsest luust in vitro kasvatatud osteoblastide metabolism on muutunud – AP/plasmiini süsteemi aktiivsus ja IGF-1 tase nendes rakkudes on suurenenud. CI Westacott jt (1997) tähelepanekut saab seletada proteaaside aktiivsuse suurenemisega subhondraalse luu rakkudes.
Pole teada, kas muutused kõhrealuses luus algatavad osteoartriidi või aitavad kaasa selle progresseerumisele. DK Dedrick jt (1993) näitasid, et kirurgiliselt esilekutsutud osteoartriidiga koertel ei ole kõhrealuse luu paksenemine osteoartroosilaadsete muutuste tekkeks vajalik tingimus, kuid aitab kaasa kõhre degeneratiivsete protsesside progresseerumisele. A. Sa'ied jt (1997) uuringu tulemused on vastuolus eelmise uuringu andmetega. Kasutades 50 MHz ehhograafiat, et hinnata liigesekõhre ja luu esialgseid morfoloogilisi muutusi ja nende progresseerumist rottide põlveliigesesse monojodoäädikhappe süstimisega esilekutsutud eksperimentaalse osteoartriidi korral, näitasid autorid luu ja kõhre samaaegset muutuste protsessi esimese kolme päeva jooksul pärast süstimist.
Osteoblastid eritavad kasvufaktoreid ja tsütokiine, mis osalevad lokaalses luu remodelleerimises ja mis võivad soodustada kõhre remodelleerumist „kaalukandvates“ liigestes pärast nende tungimist läbi liigesekõhre kaltsifitseeritud kihi mikropragude. Lisaks leidub luurakkude sekretsiooniprodukte sünoviaalvedelikus. Kõige tõenäolisemad ebanormaalsete osteoblastide poolt sekreteeritavad produktid, mis võivad algatada lokaalse kõhre remodelleerumise protsessi, on TGF-β ja luumorfomeetrilised valgud (BMP-d). Mõlemat TGF-perekonna liiget sekreteerivad nii kondrotsüüdid kui ka osteoblastid ning mõlemad on võimelised modifitseerima nii luu kui ka kõhre remodelleerumist. J. Martel Pelletier jt (1997) täheldasid osteoartroosiga patsientide subhondraalsetes luueksplantaatides TGF-β taseme tõusu võrreldes tervete inimestega, mis viitab selle kasvufaktori tõenäolisele rollile osteoartroosi patogeneesis. IGF-e toodavad samuti osteoblastid. Osteoartroosiga patsientidelt saadud osteoblastitaoliste rakkude kultuuris leiti IGF-ide taseme tõusu, mis muudavad kõhre ainevahetust.
Subhondraalses luus osteoblastide poolt toodetavad TGF-b, IGF, BMP ja tsütokiinid võivad mõjutada kollagenaasi ja teiste proteolüütiliste ensüümide tootmist kõhres, mis omakorda võib soodustada kõhremaatriksi ümberkujunemist/lagunemist. Jääb selgusetuks, kas OA-ga osteoblastid toodavad vähem makrofaagide kolooniat stimuleerivat faktorit (M-CSF - luu resorptsiooni stimulaator) kui normaalsed rakud. AG Uitterlindeni jt (1997) uuringute tulemused näitasid, et osteoblastide poolt ekspresseeritud D-vitamiini retseptorid, mis reguleerivad paljude nende rakkude poolt sünteesitud faktorite ekspressiooni, võivad mängida teatud rolli osteofüütide moodustumisel, mis osaliselt selgitab osteoblastide rolli selle haiguse patogeneesis.
Võttes arvesse ülaltoodud uuringute tulemusi, pakkusid G. Hilal jt (1998), J. Martel-Pelletier jt (1997) välja järgmise tööhüpoteesi subhondraalse luu remodelleerumise ja õige liigesekõhre vahelise seose kohta osteoartroosi korral. OA patogeneesi varases või kaugelearenenud staadiumis intensiivistub luukoe remodelleerumise protsess subhondraalses luus. Samal ajal viib korduv koormus lokaalsete mikropragude ja/või IGF/IGF-siduva valgu (IGFBP) süsteemi tasakaalustamatuse ilmnemiseni subhondraalse luu osteoblastide ebanormaalse reaktsiooni tõttu, mis aitab kaasa selle skleroosile. Viimane omakorda võib kaasa aidata õige kõhre mikropragude ilmnemisele ja selle maatriksi kahjustumisele.
Normaalsetes tingimustes parandatakse see kahjustus IGF-1 ja IGF-i siduva valgu lokaalse sünteesi ja vabanemise teel, mis stimuleerivad liigesekõhre rakuvälise meediumi (ECM) moodustumist. Samal ajal soodustab GF-süsteem subhondraalsete luurakkude kasvu ja luumaatriksi moodustumist. IGF-süsteemi anaboolne aktiivsus suureneb osteoartroosiga patsientidel subhondraalses luus, samas kui AP/plasmiini süsteemi (IGF-süsteemi lokaalne regulaator) lokaalne aktiveerimine liigesekõhredes põhjustab selle lokaalseid muutusi. Osteoartroosiga osteoblastides häirib IGF-1 AP regulatsiooni plasmiini poolt positiivse tagasiside tüübi abil, mistõttu see võib takistada luukoe ümberkujunemist, mis lõppkokkuvõttes viib subhondraalse skleroosini. Seega viib luu- ja kõhrekoes IGF-1 ja proteaaside lokaalne indutseerimine ühelt poolt kõhrekahjustuseni, teiselt poolt subhondraalse luu paksenemiseni, viimane omakorda aitab kaasa edasisele kõhrekahjustusele. Subhondraalse skleroosiga seotud kõhrekahjustuse ja selle reparatiivsete võimete vaheline tasakaalustamatus viib kõhre rakuvälise kihi (ECM) progresseeruvate muutusteni ja osteoartroosi tekkeni. Autorite sõnul selgitab see hüpotees ka haiguse aeglast progresseerumist.

