Artikli meditsiiniline ekspert
Uued väljaanded
Difteeria põhjused ja patogenees
Viimati vaadatud: 04.07.2025

Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
Difteeria on üks toksigeensete nakkushaiguste paradigma. 1883. aastal näitas Klebs, et difteeria põhjustajaks on Corynebacterium diphtheriae. Aasta hiljem leidis Loeffler, et organismi saab kultiveerida ainult ninaneeluõõnest ja pakkus välja, et siseorganite kahjustused on tingitud lahustuvast toksiinist. 1888. aastaks näitasid Roux ja Yersin, et loomadel, kellele süstiti C. diphtheriae steriilseid filtraate, tekkis elundipatoloogia, mida ei saa eristada inimese difteeriast; see näitas, et peamine virulentsustegur oli tugev eksotoksiin.
Difteeria on kõige sagedamini ülemiste hingamisteede infektsioon, mis põhjustab palavikku, kurguvalu ja halba enesetunnet. Bakterite kasvu, toksiini tootmise, aluseks oleva koe nekroosi ja peremeesorganismi immuunvastuse koosmõjul moodustub nakkuskohas(-kohtades) sageli paks hallikasroheline fibriinmembraan ehk pseudomembraan. Tuvastamine, et süsteemsed organkahjustused on tingitud difteeria toksiini toimest, on viinud nii tõhusa antitoksiinil põhineva ravi väljatöötamiseni ägeda infektsiooni raviks kui ka väga tõhusa toksoidvaktsiini väljatöötamiseni.
Kuigi toksoidimmuniseerimine on muutnud difteeria haruldaseks haiguseks piirkondades, kus rahvatervise standardid nõuavad vaktsineerimist, esineb difteeria puhanguid endiselt immuniseerimata ja immuunpuudulikkusega rühmades. Seevastu on piirkondades, kus aktiivsed immuniseerimisprogrammid on peatatud, esinenud laialdasi difteeria puhanguid, mis on saavutanud epideemilised mõõtmed.
Muud tüüpi korünebakterid
Lisaks bakteritele C. diphtheriae, C. ulcerans ja C. pseudotuberculosis võivad ka C. pseudodiphtheriticum ja C. xerosis aeg-ajalt põhjustada nina-neelu ja nahainfektsioone. Kaks viimast tüve on äratuntavad oma võime järgi toota pürasiinamidaasi. Veterinaarmeditsiinis on C. renale ja C. kutscheri olulised patogeenid, mis põhjustavad vastavalt veistel püelonefriiti ja hiirtel latentset infektsiooni.
Põhjused
Difteeria tekitaja Corynebacterium diphtheriae on õhuke, kergelt kõverdunud varras, mille otstes on kepikujulised paksendused, liikumatu; see ei moodusta eoseid, kapsleid ega flagelle ning on grampositiivne.
Lisaks toksiinile toodavad difteeria korünebakterid oma elutegevuse käigus neuraminidaasi, hüaluronidaasi, hemolüsiini, nekrotiseerivaid ja difuusseid faktoreid, mis võivad põhjustada sidekoe põhiaine nekroosi ja vedeldamist.
Toksiinide moodustamise võime põhjal jagunevad difteeria korünebakterid toksigeenseteks ja mittetoksigeenseteks.
Difteeriatoksiin on tugev bakteriaalne eksotoksiin, mis määrab nii haiguse üldised kui ka lokaalsed kliinilised ilmingud. Toksigeensus on geneetiliselt määratud. Difteeriat põhjustavad mittetoksigeensed korünebakterid haigust ei põhjusta.
Kultuuriliste ja morfoloogiliste tunnuste järgi jagunevad kõik difteeria korünebakterid kolmeks variandiks: gravis, mitis ja intermedius. Haiguse raskusaste ei sõltu otseselt difteeria korünebakterite variandist. Iga variant sisaldab nii toksigeenseid kui ka mittetoksigeenseid tüvesid. Kõikide variantide toksigeensed korünebakterid toodavad identset toksiini. [ 1 ]
Struktuur, klassifikatsioon ja antigeenitüübid
Corynebacterium diphtheriae on grampositiivne, liikumatu, nuiakujuline varrasbakter. Koekultuurides või vanemates in vitro kultuurides kasvavatel tüvedel on rakuseintes peened laigud, mis võimaldavad Grami värvimise ajal värvimuutust ja põhjustavad varieeruvat Grami reaktsiooni. Vanemad kultuurid sisaldavad sageli metakromaatilisi graanuleid (polümetafosfaat), mis värvuvad metüleensinisega sinakaslillaks. Rakuseina suhkrute hulka kuuluvad arabinoos, galaktoos ja mannoos. Lisaks võib eraldada trehaloosi toksilise 6,6'-estrit, mis sisaldab korünemükool- ja korünemükoleenhapet ekvimolaarsetes kontsentratsioonides. Eristatakse kolme erinevat kultuuritüüpi: mitis, intermedius ja gravis.
Enamik tüvesid vajab kasvuks nikotiin- ja pantoteenhapet; mõned vajavad ka tiamiini, biotiini või pimeliinhapet. Optimaalse difteeria toksiini tootmiseks tuleb keskkonda rikastada aminohapetega ja see tuleb kõrvale panna.
Juba 1887. aastal kirjeldas Loeffler avirulentsete (mittetoksigeensete) C. diphtheriae eraldamist, mida ei saanud eristada tervetelt inimestelt patsientidelt eraldatud virulentsetest (toksigeensetest) tüvedest. Nüüdseks on teada, et C. diphtheriae avirulentsed tüved võivad pärast nakatumist ja lüsogeniseerimist ühe paljudest erinevatest korünebakteriofaagidest, mis kannavad difteeria toksiini struktuurigeeni tox, abil muutuda virulentseks fenotüübiks. Avirulentse fenotüübi lüsogeenne muundamine virulentseks fenotüübiks võib toimuda nii in situ kui ka in vitro. Difteeria toksiini struktuurigeen ei ole oluline ei korünebakteriofaagi ega C. diphtheriae jaoks. Vaatamata sellele tähelepanekule ei ole difteeria toksiini geneetilist triivi täheldatud.
Pathogenesis
Nakkuse sisenemispunktideks on suuneelu, nina, kõri, harvemini silmade ja suguelundite limaskest, samuti kahjustatud nahk, haava- või põletuspinnad, mähkmelööve, paranemata nabanöörihaav. Sisenemispunktis paljuneb difteeria korünebakter ja eritab eksotoksiini.
Epiteelirakkude nekroosi ajal vabaneva trombokinaasi mõjul eritub fibrinogeenirikas eritis, mis muundatakse fibriiniks. Moodustub fibriinne kile - difteeria iseloomulik tunnus.
Asümptomaatiline nina-neelu kandlus on difteeria endeemilistes piirkondades tavaline. Tundlikel inimestel põhjustavad toksigeensed tüved haigust difteeria toksiini paljunemise ja sekreteerimise teel nina-neelus või nahakahjustustes. Difteeria kahjustus on sageli kaetud pseudomembraaniga, mis koosneb fibriinist, bakteritest ja põletikulistest rakkudest. Difteeria toksiini saab proteolüütiliselt lõhustada kaheks fragmendiks: N-terminaalne fragment A (katalüütiline domeen) ja fragment B (transmembraansed ja retseptoriga seonduvad domeenid). Fragment A katalüüsib elongatsioonifaktori 2 NAD+-sõltuvat ADP-ribosüülimist, pärssides seeläbi valgusünteesi eukarüootsetes rakkudes. Fragment B seondub rakupinna retseptoriga ja hõlbustab fragmendi A kohaletoimetamist tsütosooli.
Kaitsev immuunsus hõlmab antikehade teket difteeria toksiini suhtes pärast kliinilist haigust või difteeria toksiini (formaldehüüdi poolt inaktiveeritud toksiin) suhtes pärast immuniseerimist.
Koloniseerimine
C. diphtheriae koloniseerimist vahendavate tegurite kohta on vähe teada. Siiski on selge, et peale difteeria toksiini tootmise aitavad virulentsusele kaasa ka muud tegurid. Epidemioloogilised uuringud on näidanud, et antud lüsotüüp võib populatsioonis püsida pikka aega. Hiljem võib see asenduda teise lüsotüübiga. Uue lüsotüübi teke ja sellele järgnev domineerimine populatsioonis on arvatavasti seotud selle võimega koloniseerida ja tõhusalt konkureerida oma nina-neelu ökoloogilise niši segmendis. Corynebacterium diphtheriae suudab toota neuraminidaasi, mis lõhustab rakupinna siaalhappe selle komponentideks püruvaadiks ja N-atsetüülneuramiinhappeks. Nöörifaktor (6,6'-di-O-mükoloüül-α, α'-D-trehaloos) on C. diphtheriae pinnakomponent, kuid selle roll inimese peremeesorganismi koloniseerimisel on ebaselge.
Difteeriatoksiinide tootmine
Difteeriatoksiini struktuurgeen tox kuulub lähedalt seotud korünebakteriofaagide perekonda, millest β-faag on kõige paremini uuritud. Difteeriatoksiini ekspressiooni regulatsiooni vahendab raua poolt aktiveeritav repressor DtxR, mida kodeerib C. diphtheriae genoom. Toksiini ekspressioon sõltub C. diphtheriae füsioloogilisest seisundist. Tingimustes, kus rauast saab kasvukiirust piirav substraat, dissotsieerub raud DtxR-ist, toksikodendroni geen aktiveerub ning difteeria toksiin sünteesitakse ja sekreteeritakse maksimaalse kiirusega söötmesse.
Difteeriatoksiin on ebatavaliselt tugev; vastuvõtlikele liikidele (nt inimesed, ahvid, küülikud, merisead) on surmav juba 100–150 ng/kg kehakaalu kohta. Difteeriatoksiin koosneb ühest 535 aminohappest koosnevast polüpeptiidahelast. Biokeemiline, geneetiline ja röntgenstruktuurianalüüs näitab, et toksiin koosneb kolmest struktuurilisest/funktsionaalsest domeenist:
- N-terminaalne ADP-ribosüültransferaas (katalüütiline domeen);
- piirkond, mis hõlbustab katalüütilise domeeni kohaletoimetamist läbi rakumembraani (transmembraanne domeen);
- eukarüootsete rakkude retseptori sidumisdomeen.
Pärast kerget trüpsiiniga lõhustamist ja denatureerivates tingimustes redutseerimist saab difteeria toksiini spetsiifiliselt lõhustada proteaasitundliku silmuse kaudu kaheks polüpeptiidfragmendiks (A ja B). Fragment A on toksiini N-terminaalne 21 kDa komponent ja sisaldab katalüütilist saiti elongatsioonifaktori 2 (EF-2) ADP-ribosüleerimiseks.
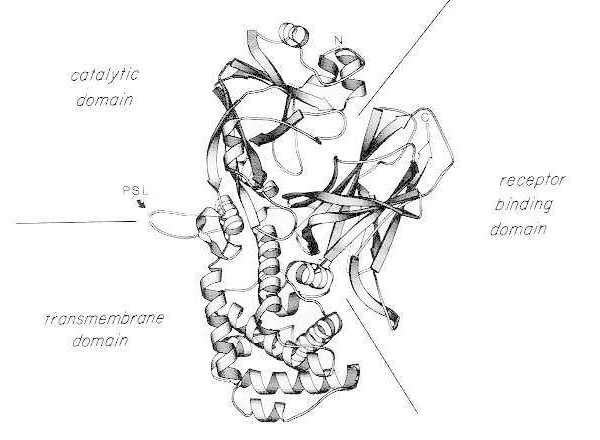
Monomeerse natiivse difteeria toksiini röntgenkristallstruktuuri lintdiagramm. (muudetud Bennett MJ, Choe S, Eisenberg D: Domeenivahetus: valkude vahelised põimumised. Proc Natl Acad Sci, USA, 91: 3127, 1994). Näidatud on katalüütiliste, transmembraansete ja retseptoriga seonduvate domeenide suhtelised asukohad. Tervet toksiini saab lõhustada trüpsiinilaadsete proteaaside abil Arg190, Arg192 ja/või Arg193 juures, mis paiknevad proteaasitundlikus ahelas (PSL). Pärast disulfiidsilla redutseerimist Cys186 ja Cys201 vahel saab toksiini lahutada A- ja B-fragmentideks. Näidatud on terve toksiini aminoots (N) ja karboksüots (C). Ribadiagramm loodi MOLESCRIPT programmi abil.
C-terminaalne fragment, fragment B, kannab toksiini transmembraanset ja retseptoriga seondumise domeeni.
Ühe eukarüootse raku mürgitamine difteeria toksiiniga hõlmab vähemalt nelja erinevat etappi:
- toksiini seondumine oma retseptoriga raku pinnal;
- laetud retseptorite klasterdumine kaetud süvenditesse ja toksiini internaliseerimine retseptorvahendatud endotsütoosi kaudu; pärast endotsüütilise vesiikuli hapestamist membraaniga seotud ATP-põhise prootonpumba abil,
- transmembraanse domeeni sisestamine membraani ja katalüütilise domeeni tsütosooli toimetamise hõlbustamine ning
- EF-2 ADP-ribosüülimine, mille tulemuseks on valgusünteesi pöördumatu pärssimine.
On näidatud, et ühest katalüütilise domeeni molekulist, mis manustatakse tsütosooli, piisab rakule surmavaks muutumiseks.
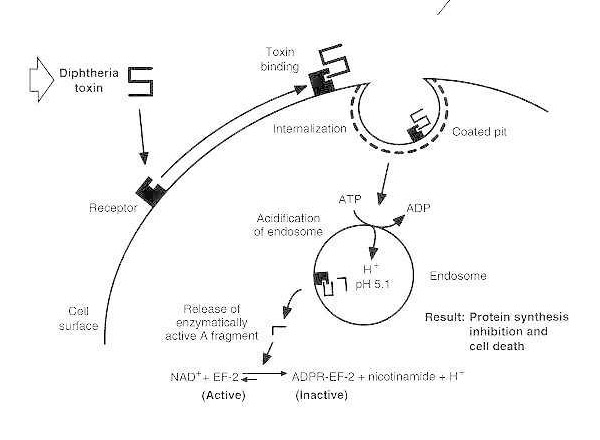
Difteeria mürgistuse skemaatiline diagramm vastuvõtlikus eukarüootses rakus.
Toksiin seondub oma rakupinna retseptoriga ja internaliseeritakse retseptorvahendatud endotsütoosi kaudu; endosoomi hapestamisel sisestatakse transmembraanne domeen vesiikulite membraani; katalüütiline domeen toimetatakse tsütosooli, mis viib valgusünteesi pärssimiseni ja rakusurmani.
Epidemioloogia
Enne USA elanikkonna massilist immuniseerimist difteeria toksoidiga oli difteeria tavaliselt lastehaigus. Difteeria toksoidiga massilise immuniseerimise tähelepanuväärne aspekt on see, et kuna elanikkonna osakaal, kellel on kaitsva antitoksiini immuunsuse tase (≥ 0,01 RÜ/ml), suureneb, väheneb toksigeensete tüvede eraldamise sagedus populatsioonist. Tänapäeval on Ameerika Ühendriikides, kus kliiniline difteeria on peaaegu täielikult kadunud, C. diphtheriae toksigeensete tüvede eraldamine haruldane. Kuna subkliiniline infektsioon ei ole enam difteeria antigeeniga kokkupuute allikas ja kui immuunsust ei võimendata, siis antitoksiini suhtes immuunsus väheneb, on suurel osal täiskasvanutest (30–60%) antitoksiini tase alla kaitsva taseme ja nad on ohus. Ameerika Ühendriikides, Euroopas ja Ida-Euroopas on hiljutised difteeria puhangud esinenud peamiselt alkoholi ja/või narkootikume kuritarvitavate inimeste seas. Selles rühmas on toksigeense C. diphtheriae kandjatel mõõdukalt kõrge antitoksiini immuunsuse tase. Hiljutine rahvatervise meetmete kokkuvarisemine Venemaal on viinud selleni, et difteeria on muutunud epideemiaks. 1994. aasta lõpuks oli Venemaal registreeritud üle 80 000 haigusjuhtu ja üle 2000 surmajuhtumi.
Difteeria fokaalsed puhangud on peaaegu alati seotud immuunkandjaga, kes on naasnud piirkonnast, kus difteeria on endeemiline. Tõepoolest, hiljutised kliinilise difteeria puhangud Ameerika Ühendriikides ja Euroopas on seostatud reisijatega, kes on naasnud Venemaalt ja Ida-Euroopast. C. diphtheriae toksigeensed tüved levivad otse inimeselt inimesele õhus levivate piiskade kaudu. On teada, et toksigeensed tüved võivad otseselt koloniseerida ninaneeluõõnt. Lisaks võib toksigeenset geeni levitada kaudselt toksigeense korünebakteriofaagi vabastamise ja mittetoksigeense autohtoonse C. diphtheriae lüsogeense transformatsiooni kaudu kohapeal. [ 5 ]
Lisaks C. diphtheriae isolaatide biotüübi ja lüsotüübi määramisele saab nüüd difteeria puhangute uurimiseks kasutada molekulaarbioloogia meetodeid. Kliiniliste puhangute uurimiseks on kasutatud C. diphtheriae kromosomaalse DNA restriktsiooniendonukleaaside seedimise mustreid, nagu ka kloonitud korünebakterite insertsioonijärjestuste kasutamist geneetilise sondina.
Schicki testi on aastaid kasutatud difteeria toksiini immuunsuse hindamiseks, kuigi paljudes piirkondades on see nüüdseks asendatud seroloogilise testiga, mis määrab spetsiifilised antikehad difteeria toksiini suhtes. Schicki testi käigus süstitakse väike kogus difteeria toksiini (umbes 0,8 ng 0,2 ml-s) nahasiseselt käsivarde (testitav koht) ja 0,0124 μg difteeria toksiini 0,2 ml-s süstitakse nahasiseselt kontrollkohta. Näidud võetakse 48 ja 96 tunni möödudes. Mittespetsiifilised nahareaktsioonid saavutavad tavaliselt haripunkti 48 tunni möödudes. 96 tunni möödudes näitab erüteemiline reaktsioon koos võimaliku nekroosiga testkohas ebapiisavat antitoksilist immuunsust toksiini neutraliseerimiseks (≤ 0,03 RÜ/ml). Põletik nii test- kui ka kontrollpiirkonnas 48 tunni pärast näitab ülitundlikkusreaktsiooni antigeenipreparaadi suhtes.
Vormid
Corynebacterium diphtheriae nakatab ninaneelu või nahka. Toksigeensed tüved toodavad tugevat eksotoksiini, mis võib põhjustada difteeriat. Difteeria sümptomiteks on farüngiit, palavik ja kaela või nahakahjustuse ümbritseva piirkonna turse. Difteerilised kahjustused on kaetud pseudomembraaniga. Toksiin levib vereringe kaudu kaugematesse organitesse ja võib põhjustada halvatust ja südame paispuudulikkust. [ 6 ]
Kliinilist difteeriat on kahte tüüpi: nasofarüngeaalne ja naha difteeria. Farüngeaalse difteeria sümptomid ulatuvad kergest farüngiidist kuni hüpoksiani, mis on tingitud hingamisteede obstruktsioonist pseudomembraani poolt. Emakakaela lümfisõlmede kahjustus võib põhjustada kaela tugevat turset (härjakaela difteeria) ja patsiendil võib tekkida palavik (≥ 38°C). Naha difteeria korral on nahakahjustused tavaliselt kaetud hallikaspruuni pseudomembraaniga. Difteeriatoksiini toimel perifeersetele motoorsetele neuronitele ja müokardile võivad tekkida eluohtlikud süsteemsed tüsistused, peamiselt motoorse funktsiooni kaotus (nt neelamisraskused) ja südame paispuudulikkus.
Kontroll
Difteeria tõrje sõltub piisavast immuniseerimisest difteeria toksoidiga: see on formaldehüüdi poolt inaktiveeritud difteeria toksiin, mis jääb antigeenselt terveks. Toksoidi valmistatakse difteeria toksiini inkubeerimisel formaldehüüdiga temperatuuril 37 °C aluselistes tingimustes. Difteeria immuniseerimine peaks algama teisel elukuul kolme esmase annusega 4–8-nädalaste intervallidega, millele järgneb neljas annus umbes aasta pärast viimast esmast vaktsineerimist. Difteeria toksoidi kasutatakse laialdaselt difteeria-läkaköha-teetanuse (DPT) vaktsiini osana. Epidemioloogilised uuringud on näidanud, et difteeria vastane immuniseerimine on ligikaudu 97% efektiivne. Kuigi Ameerika Ühendriikides ja Euroopas praktiseeritakse massilist immuniseerimist difteeria vastu ning laste immuniseerimise määr on piisav, võib suurel osal täiskasvanud elanikkonnast olla antikehade tiitrid alla kaitsva taseme. Täiskasvanuid tuleks difteeria toksoidiga revaktsineerida iga 10 aasta tagant. Tõepoolest, reisijatele, kes külastavad piirkondi, kus on kõrge endeemilise difteeria esinemissagedus (Kesk- ja Lõuna-Ameerika, Aafrika, Aasia, Venemaa ja Ida-Euroopa), tuleks teha revaktsineerimine difteeria-teetanuse toksoidiga. Viimastel aastatel on immuniseerimiseks kasutatud ülipuhastatud toksoidpreparaate, mis minimeerisid aeg-ajalt esinevaid raskeid ülitundlikkusreaktsioone. Difteeria-teetanuse toksoidiga tuleks reisijatele, kes külastavad piirkondi, kus on kõrge endeemilise difteeria esinemissagedus (Kesk- ja Lõuna-Ameerika, Aafrika, Aasia, Venemaa ja Ida-Euroopa), tuleks teha revaktsineerimine difteeria-teetanuse toksoidiga. Viimastel aastatel on immuniseerimiseks kasutatud ülipuhastatud toksoidpreparaate, mis minimeerisid aeg-ajalt esinevaid raskeid ülitundlikkusreaktsioone. Difteeria-teetanuse toksoidiga tuleks revaktsineerida reisijatele, kes külastavad piirkondi, kus on kõrge endeemilise difteeria esinemissagedus (Kesk- ja Lõuna-Ameerika, Aafrika, Aasia, Venemaa ja Ida-Euroopa). Viimastel aastatel on immuniseerimiseks kasutatud ülipuhastatud toksoidpreparaate, mis minimeerisid aeg-ajalt esinevaid raskeid ülitundlikkusreaktsioone.
Kuigi difteeriahaigete ravis kasutatakse antibiootikume (näiteks penitsilliini ja erütromütsiini), on kiire passiivne immuniseerimine difteeria antitoksiiniga suremuse vähendamisel kõige tõhusam. Spetsiifilise antitoksiini pikk poolväärtusaeg vereringes on oluline tegur difteeria toksiini tõhusa neutraliseerimise tagamisel; efektiivsuse tagamiseks peab antitoksiin aga enne rakku sisenemist toksiiniga reageerima.
Difteeriatoksiini ümberkujundamine eukarüootsete retseptorspetsiifiliste tsütotoksiinide arendamiseks
Valgutehnoloogia on molekulaarbioloogias uus ja kiiresti arenev valdkond; see ühendab rekombinantse DNA metoodikaid ja tahkefaasilise DNA sünteesi, et kujundada ja konstrueerida kimäärseid geene, mille produktidel on ainulaadsed omadused. Difteeriatoksiini struktuuri ja funktsiooni seoste uuringud on selgelt näidanud, et see toksiin on kolme domeeniga valk: katalüütiline, transmembraanne ja retseptorvalk. Difteeriatoksiini natiivset retseptoriga seondumise domeeni on geneetiliselt võimalik asendada erinevate polüpeptiidhormoonide ja tsütokiinidega (nt α-melanotsüüte stimuleeriv hormoon [α-MSH], interleukiin (IL) 2, IL-4, IL-6, IL-7, epidermise kasvufaktor). Saadud kimäärsed valgud või fusioontoksiinid ühendavad tsütokiini retseptoriga seondumise spetsiifilisuse toksiini transmembraansete ja katalüütiliste domeenidega. Igal juhul näidati, et fusioontoksiinid mürgitavad selektiivselt ainult neid rakke, mis kannavad vastavat sihtretseptorit. Esimest neist geneetiliselt muundatud fusioontoksiinidest, DAB 389IL-2, hinnatakse praegu inimeste kliinilistes uuringutes refraktaarsete lümfoomide ja autoimmuunhaiguste raviks, mille patogeneesis mängivad olulist rolli kõrge afiinsusega IL-2 retseptoritega rakud.[ 7 ] DAB 389 IL-2 manustamine osutus ohutuks, hästi talutavaks ja võimeliseks esile kutsuma püsiva haiguse remissiooni ilma tõsiste kõrvaltoimeteta. On tõenäoline, et difteeria toksiinil põhinevad fusioontoksiinid saavad olulisteks uuteks bioloogilisteks aineteks spetsiifiliste kasvajate või haiguste raviks, mille puhul saab sihtida spetsiifilisi rakupinna retseptoreid.


 [
[