Artikli meditsiiniline ekspert
Uued väljaanded
Ravimid
Neuroleptikumid ehk antipsühhootikumid
Viimati vaadatud: 04.07.2025

Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
Antipsühhootikumid (neuroleptikumid) on psühhotroopsete ravimite klass, mida kasutatakse peamiselt skisofreenia raviks. Praegu on tavaline eristada kahte ravimirühma (või kategooriat): tüüpilised ja atüüpilised antipsühhootikumid. Allpool on esitatud teave iga ravimirühma farmakoloogiliste omaduste, näidustuste ja kõrvaltoimete kohta.
Tüüpiliste antipsühhootikumide kasutamise näidustused
Praegu on traditsiooniliste neuroleptikumide väljakirjutamise peamised näidustused vastavalt psühhofarmakoteraapia valdkonna autoriteetsete teadlaste soovitustele järgmised.
- Raskete psühhootiliste sümptomite põhjustatud psühhomotoorse agitatsiooni ja käitumishäirete leevendamine. Nendel juhtudel on näidustatud antipsühhootilise toimega ravimite suukaudsete või parenteraalsete vormide kasutamine, nii globaalse (klopromasiin, levomepromasiin, tioproperasiin, zuklopentiksool) kui ka selektiivse - hallutsinatoorsete-paranoiliste häirete (haloperidool, trifluoperasiin) mõju kujul.
- Retsidiivivastane (ennetav) ravi. Sel eesmärgil määratakse ravimite depoovorme, eriti patsientidel, kellel on halb ravijärgimine (haloperidooldekanoaat, flupentiksool pikatoimeline vorm), või väikeseid või keskmisi ravimiannuseid disinhibeeriva (antinegatiivse) efekti saavutamiseks nende ravimite hulgast, mille suuri annuseid kasutatakse ägedate psühhootiliste häirete leevendamiseks (flupentiksool, zuklopentiksool). Seda tüüpi ravis on soovitatav määrata ka nn väikeseid neuroleptikume (tioridasiin, klorprotikseen, sulpiriid), mille psühhotroopne toime seisneb depressiivse pooluse ja unetuse ilmingute mõjutamises.
- Ägedate psühhootiliste seisundite ravis atüüpiliste antipsühhootikumide resistentsuse ületamine. Selleks kasutatakse tavaliselt traditsiooniliste antipsühhootikumide parenteraalseid vorme, millel on globaalne (kloorpromasiin, levomepromasiin jne) ja selektiivne (haloperidool) antipsühhootiline toime.
Need ravimid põhjustavad mitmesuguseid kõrvaltoimeid, mille iseloom sõltub iga ravimi farmakoloogilise profiili iseärasustest. Tugevama kolinolüütilise toimega antipsühhootikumid põhjustavad sagedamini akommodatsioonihäireid, kõhukinnisust, suukuivust ja uriinipeetust. Rahustav toime on tüüpilisem väljendunud antihistamiiniefektiga antipsühhootikumidele ja ortostaatiline hüpotensioon on tüüpilisem ravimitele, mis blokeerivad α1-adrenergilisi retseptoreid. Kolinergilise, noradrenergilise ja dopamiinergilise ülekande blokeerimine tüüpiliste neuroleptikumide poolt võib põhjustada mitmeid seksuaalsfääri häireid, nagu amenorröa või düsmenorröa, anorgasmia, galaktorröa, piimanäärmete turse ja valulikkus ning potentsi langus. Seksuaalsfääri kõrvaltoimed on peamiselt seotud nende ravimite kolinolüütiliste ja adrenoblokeerivate omadustega, samuti prolaktiini sekretsiooni suurenemisega dopamiini metabolismi blokeerimise tõttu. Tüüpiliste neuroleptikumide kõige tõsisemad kõrvaltoimed on motoorsed häired. Need on kõige levinum põhjus, miks patsiendid ravimite võtmise lõpetavad. Kolm peamist motoorse sfääri mõjutamisega seotud kõrvaltoimet on varajased ekstrapüramidaalsündroomid, tardiivne düskineesia ja malign neuromuskulaarne sündroom.
Ekstrapüramidaalsed sündroomid on arvatavasti seotud D2-retseptorite blokaadiga basaalganglionides. Nende hulka kuuluvad düstoonia, neuroleptiline parkinsonism ja akatiisia. Ägeda düstoonilise reaktsiooni (varajase düskineesia) ilmingute hulka kuuluvad äkki tekkiv hüperkinees, okulogüürilised kriisid, näo- ja kerelihaste kokkutõmbed, opistotoonus. Need häired on annusest sõltuvad ja tekivad sageli pärast 2-5-päevast ravi tugevate neuroleptikumidega, nagu haloperidool ja flufenasiin. Varajase düskineesia leevendamiseks vähendatakse neuroleptikumi annust ja määratakse antikolinergilisi ravimeid (biperideen, triheksüfenidüül). Tardiivne düskineesia hõlmab tavaliselt kaelalihaseid ja erinevalt ägedast düstoonilise reaktsioonist reageerib see antikolinergilistele ravimitele vähem. Neuroleptilist parkinsonismi iseloomustavad spontaansete motoorsete oskuste vähenemine, hüpo- ja amiimia, puhkeseisundi treemor ja jäikus. Oluline on eristada neid sümptomeid skisofreenia väliselt sarnastest negatiivsetest häiretest, mida esindavad emotsionaalne võõrandumine, afektiivsuse tuhmumine ja energiapuudus. Nende kõrvaltoimete korrigeerimiseks on näidustatud antikolinergiliste ravimite kasutamine, neuroleptikumi annuse vähendamine või selle asendamine atüüpilise antipsühhootikumiga. Akatiisia avaldub sisemise ärevusena, võimetusena pikka aega ühes kohas püsida ja vajadusena pidevalt käsi või jalgu liigutada. Selle leevendamiseks kasutatakse antikolinergilisi ravimeid ja tsentraalseid beetablokaatoreid (propranolool).
Hiline düskineesia avaldub mis tahes lihasrühma, kõige sagedamini keele ja suu lihaste, tahtmatute liigutustena. Kliiniliselt eristatakse mitmeid selle vorme: põskede, keele ja suu lihaste düskineesia (mälumislihaste perioodilised kokkutõmbed, mis tekitavad grimasseeriva inimese mulje, keel võib tahtmatult patsiendi suust välja paista); tardiivne düstoonia ja tardiivne akatiisia (patsient teeb pea, kere, üla- ja alajäsemete koreoatetoidseid liigutusi). Seda häire vormi registreeritakse peamiselt traditsiooniliste neuroleptikumidega pikaajalise ravi ajal ja seda avastatakse ligikaudu 15–20% patsientidest, kes võtavad neid säilitusravina. Tõenäoliselt on mõnedel patsientidel düskineesia sümptomite tekkimise risk suurenenud, kuna mõnda neist täheldati skisofreenia kliinikus juba enne "neuroleptikumide ajastut". Lisaks on tardiivset düskineesiat kirjeldatud eakatel naistel ja afektiivsete häiretega patsientidel. Arvatakse, et tardiivne düskineesia on seotud dopamiiniretseptorite arvu suurenemisega striatumis, kuigi selle patogeneesis osalevad tõenäoliselt ka GABAergilised ja teised neurotransmitterisüsteemid. Selliste kõrvaltoimete korral puudub efektiivne universaalne ravi. On oletatud, et dopamiini blokeeriva toimega suure potentsiaaliga neuroleptikumide või E-vitamiini väikesed annused võivad nende häirete korral avaldada mõõdukat kasulikku mõju. Tardiivse düskineesia kõige tõhusam meede on tüüpilise neuroleptikumi annuse vähendamine või selle asendamine atüüpilise antipsühhootikumiga.
Praeguste andmete kohaselt esineb pahaloomuline neuroleptiline sündroom ligikaudu 0,5% psühhofarmakoteraapia juhtudest. Tõenäoliselt saab sellise eluohtliku tüsistuse haruldast esinemist praegu seletada atüüpiliste antipsühhootikumide laialdase kasutuselevõtuga praktikas, kuna nende ravimitega ravi ajal on MNS-i tekkerisk ebaoluline. Üldiselt arvatakse, et MNS-i tekke peamine põhjus on dopamiinergilise süsteemi liigne blokeerimine neuroleptikumidega ravi ajal, eriti pärast väga tugevatoimelise antipsühhootikumi annuse suurendamist. MNS-i peamised sümptomid on hüpertermia, skeletilihaste ja kõõluste reflekside toonuse suurenemine, teadvusehäired koos kooma üleminekuga. Vereanalüüsid näitavad leukotsütoosi, erütrotsüütide settereaktsiooni ja maksa transaminaaside aktiivsuse suurenemist; uriinianalüüsid näitavad albumiinuuria esinemist. Vee ja elektrolüütide tasakaalu häired tekivad kiiresti, mis loob eeldused ajuödeemi tekkeks. MNS on äge seisund, mis nõuab patsiendi kiiret hospitaliseerimist intensiivseks infusioonraviks. MNS-i ravis on kõige olulisem hüdratsioon ja sümptomaatiline ravi. Sellises olukorras tuleb kõik välja kirjutatud neuroleptikumid koheselt ära jätta. Mõnel juhul on dopamiini retseptori agonistidel (näiteks bromokriptiinil) või lihasrelaksantidel positiivne toime, kuigi nende efektiivsust ei ole uuritud. Pärast NMS-i kõrvaldamist ei tohiks neuroleptikumi võtmist jätkata vähemalt kahe nädala jooksul. Seejärel võib välja kirjutada madala tugevusega antipsühhootikumi, eelistatavalt uue põlvkonna ravimit. Uue ravimi annust tuleb suurendada äärmiselt ettevaatlikult, jälgides elutähtsate funktsioonide seisundit ja laboratoorseid andmeid (vere- ja uriinianalüüsid).
Tüüpilised neuroleptikumid põhjustavad harva ohtlikke surmaga lõppevaid tüsistusi. Üledoosi ilmingud on peamiselt seotud ravimi antiadrenergilise ja antikolinergilise toime individuaalse profiiliga. Kuna neil ravimitel on tugev antiemeetiline toime, on nende organismist eemaldamiseks näidustatud maoloputus, mitte emeetikumide manustamine. Arteriaalne hüpotensioon on reeglina adrenergiliste retseptorite blokaadi tagajärg ja seda tuleks korrigeerida dopamiini ja norepinefriini manustamisega. Südame rütmihäirete korral on näidustatud lidokaiini kasutamine.
Tüüpiliste antipsühhootikumide toimemehhanism ja farmakoloogilised efektid
Psühhofarmakoloogia arenedes pakuti välja mitmesuguseid antipsühhootikumide mõju neuroretseptoritele. Peamine hüpotees jääb samaks, et need mõjutavad dopamiini neurostruktuure (peamiselt D2-retseptoreid), mis põhineb andmetel normaalse dopamiini metabolismi häirete kohta aju struktuurides psühhooside korral. Dopamiini D2-retseptorid asuvad basaalganglionides, nucleus accumbensis ja frontaalkorteksis; neil on juhtiv roll infovoo reguleerimisel ajukoore ja talamuse vahel.
Joonis demonstreerib detailsemat arusaama dopamiini ülekande häiretest aju kortikaalsetes ja subkortikaalsetes piirkondades ning nende häirete rollist skisofreenia sümptomite tekkes (kohandatud Jones RB, Buckley PF, 2006 monograafiast).
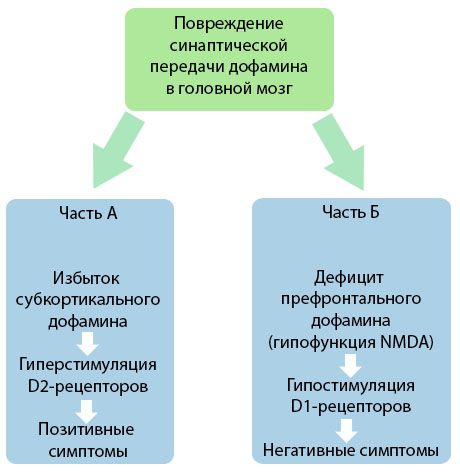
A-osa peegeldab klassikalist, varajast dopamiini teooriat, mis postuleerib dopamiini liigset esinemist subkortikaalsetes piirkondades ja D2-retseptorite hüperstimulatsiooni, mis viib produktiivsete sümptomite tekkeni. B-osa demonstreerib teooria hilisemat moderniseerimist 1990. aastate alguses. Selleks ajaks saadud andmed näitasid, et dopamiini puudus D-retseptorites koos nende retseptorite ebapiisava stimuleerimisega prefrontaalses ajukoores viib negatiivsete sümptomite ja kognitiivsete defitsiitide tekkeni. Seega on tänapäevase arusaama kohaselt mõlemad dopamiinergilise ülekande häirete tüübid – subkortikaalse dopamiini liigse esinemine ja selle puudus prefrontaalses ajukoores – prefrontaalse piirkonna sünaptilise ülekande häire kombineeritud tagajärg ja on seotud N-metüül-N-aspartaadi hüpofunktsiooniga. Lisaks algselt isoleeritud dopamiinile tuvastati hiljem ka teisi skisofreenia patogeneesis osalevaid neurotransmittereid, nagu serotoniin, gamma-aminovõihape, glutamaat, norepinefriin, atsetüülkoliin ja mitmesugused neuropeptiidid. Kuigi nende mediaatorite rolli pole täielikult uuritud, selgub teadmiste arenedes, et arvukate neurokeemiliste nihete avaldumine organismis. Seetõttu on antipsühhootilise ravimi kliiniline toime erinevatele retseptorite moodustistele avalduva mõju summa ja viib homöostaasi häirete kõrvaldamiseni.
Viimastel aastatel on tänu uute uurimismeetodite, näiteks radioisotoopligandide sidumise ja PET-skaneerimise tekkimisele tehtud märkimisväärseid edusamme neuroleptikumide peene biokeemilise toimemehhanismi selgitamisel. Eelkõige on kindlaks tehtud ravimite võrdlev tugevus ja tropism üksikute neuroretseptoritega seondumisel aju erinevates piirkondades ja struktuurides. On näidatud ravimi antipsühhootilise toime raskusastme otsest sõltuvust selle blokeeriva toime tugevusest erinevatele dopamiinergilistele retseptoritele. Hiljuti on tuvastatud neli tüüpi selliseid retseptoreid:
- D1 paiknevad valdavalt mustaine ja striatumi piirkonnas (nn nigrostriataalne piirkond), samuti prefrontaalses piirkonnas;
- D2 - nigrostriataalses, mesolimbilises piirkonnas ja hüpofüüsi eesmises osas (prolaktiini sekretsioon);
- D3 (presünaptiline) - kontrollib erinevates aju struktuurides dopamiinergilist aktiivsust vastavalt negatiivse tagasiside seadusele;
- D4 (presünaptiline) - valdavalt nigrostriataalses ja mesolimbilises piirkonnas.
Samal ajal võib nüüd pidada tõestatuks, et just D2-retseptorite blokeerimine põhjustab antipsühhootiliste, sekundaarsete sedatiivsete toimete ja ekstrapüramidaalsete kõrvaltoimete teket. Seda tüüpi retseptorite blokeerimise teised kliinilised ilmingud on neuroleptikumide valuvaigistav ja antiemeetiline toime (iivelduse ja oksendamise vähenemine oksendamiskeskuse pärssimise tagajärjel), samuti kasvuhormooni sisalduse vähenemine ja prolaktiini tootmise suurenemine (neuroendokriinsed kõrvaltoimed, sealhulgas galaktorröa ja menstruaaltsükli häired). Nigrostriataalsete D2-retseptorite pikaajaline blokeerimine viib nende ülitundlikkuse ilmnemiseni, mis vastutab tardiivse düskineesia ja "ülitundlikkuspsühhooside" tekke eest. Presünaptiliste D3- ja D4-retseptorite blokeerimise tõenäolised kliinilised ilmingud on seotud peamiselt neuroleptikumide stimuleeriva toimega. Nende retseptorite osalise blokeerimise tõttu nigrostriataalses ja mesolimbokortikaalses piirkonnas võivad aktiveerivad ja intsisiivsed (võimsad, väga aktiivsed) neuroleptikumid väikestes annustes stimuleerida ja suurtes annustes pärssida dopamiinergilist ülekannet.
Viimastel aastatel on järsult suurenenud huvi aju serotonergiliste süsteemide, sealhulgas serotoniini retseptorite funktsiooni vastu. Fakt on see, et aju erinevates osades on serotonergilisel süsteemil moduleeriv toime dopamiinergilistele struktuuridele. Eelkõige mesokortikaalses piirkonnas pärsib serotoniin dopamiini vabanemist ja vastavalt sellele viib postsünaptiliste 5-HT1A retseptorite blokeerimine dopamiini sisalduse suurenemiseni. Nagu teada, on skisofreenia negatiivsete sümptomite teke seotud dopamiini neuronite hüpofunktsiooniga ajukoore prefrontaalsetes struktuurides. Praegu on teada umbes 15 tüüpi tsentraalseid 5-HT1A retseptoreid. Eksperimentaalselt on avastatud, et neuroleptikumid seonduvad peamiselt esimese kolme tüübi 5-HT1A retseptoritega.
Nendel ravimitel on peamiselt stimuleeriv (agonistlik) toime 5-HT1a retseptoritele. Tõenäolised kliinilised tagajärjed: suurenenud antipsühhootiline toime, kognitiivsete häirete raskusastme vähenemine, negatiivsete sümptomite korrektsioon, antidepressiivne toime ja ekstrapüramidaalsete kõrvaltoimete esinemissageduse vähenemine.
Neuroleptikumide mõju 5-HT2 retseptoritele, eriti 5-HT2a alatüüpidele, on olulise tähtsusega. Need paiknevad peamiselt ajukoores ja nende tundlikkus on skisofreeniahaigetel suurenenud. Uue põlvkonna neuroleptikumide võime vähendada negatiivsete sümptomite raskust, parandada kognitiivseid funktsioone, reguleerida und aeglase laine (D-laine) une faaside kogukestuse suurendamise kaudu, vähendada agressiivsust ning leevendada depressioonisümptomeid ja migreenilaadseid (tserebrovaskulaarsete häirete tõttu tekkivaid) peavalusid on seotud 5-HT2a retseptorite blokeerimisega. Teisest küljest on 5-HT2a retseptorite blokeerimise korral võimalik hüpotensiivne toime ja ejakulatsioonihäired meestel.
Arvatakse, et neuroleptikumide mõju 5-HT2c retseptoritele põhjustab rahustavat (anksiolüütilist) toimet, suurenenud isu (millega kaasneb kehakaalu suurenemine) ja prolaktiini tootmise vähenemine.
5-HT3 retseptorid paiknevad valdavalt limbilises piirkonnas ja nende blokeerimisel tekib esmalt antiemeetiline toime ning tugevnevad ka antipsühhootiline ja anksiolüütiline toime.
Parkinsonismilaadsete sümptomite esinemine sõltub ka ravimi blokeerivast võimest muskariini kolinergilistele retseptoritele. Kolinolüütiline ja dopamiini blokeeriv toime on teatud määral vastastikuses seoses. Näiteks on teada, et nigrostriataalses piirkonnas pärsivad D2-retseptorid atsetüülkoliini vabanemist. Kui enam kui 75% nigrostriataalse piirkonna D2-retseptoritest on blokeeritud, häirub tasakaal kolinergilise süsteemi kasuks. See on antikolinergiliste ravimite (korrektorite) korrigeeriva toime põhjus neuroleptiliste ekstrapüramidaalsete kõrvaltoimete osas. Klorprotikseenil, kloasapiinil ja olansapiinil on kõrge afiinsus muskariini retseptorite suhtes ja nad praktiliselt ei põhjusta ekstrapüramidaalseid kõrvaltoimeid, kuna nad blokeerivad samaaegselt nii kolinergilisi kui ka dopamiinergilisi retseptoreid. Haloperidooli ja piperasiini fenotiasiini derivaatidel on väljendunud toime dopamiini retseptoritele, kuid väga nõrk mõju koliini retseptoritele. See on tingitud nende võimest põhjustada väljendunud ekstrapüramidaalseid kõrvaltoimeid, mis vähenevad väga suurte annuste kasutamisel, kui kolinolüütiline toime muutub märgatavaks. Lisaks nigrostriataalse piirkonna D2-retseptorite dopamiini blokeeriva toime vähendamisele ja ekstrapüramidaalsete kõrvaltoimete tasandamisele võib tugev koliinergiline toime põhjustada kognitiivsete funktsioonide halvenemist, sealhulgas mäluhäireid, samuti perifeerseid kõrvaltoimeid (kuivad limaskestad, nägemise halvenemine, kõhukinnisus, uriinipeetus, segasus jne). Neuroleptikumidel on I tüüpi histamiini retseptoritele üsna tugev blokeeriv toime, mis on seotud eelkõige sedatiivse toime raskusega, samuti kehakaalu suurenemisega suurenenud isu tõttu. Neuroleptikumide allergiavastane ja sügelusevastane toime on seotud ka nende antihistamiiniliste omadustega.
Lisaks dopamiini blokeerivale, antiserotonergilisele, kolinolüütilisele ja antihistamiinilisele toimele on enamikul neuroleptikumidel adrenolüütilised omadused, st nad blokeerivad nii tsentraalseid kui ka perifeerseid a1-adrenoretseptoreid. Adrenoblokaatoritel nagu klorpromasiin ja klorprotikseen on väljendunud rahustav toime. Lisaks võib nende ravimite blokeeriv toime põhjustada neurovegetatiivseid kõrvaltoimeid (arteriaalne hüpotensioon, tahhükardia jne), samuti adrenoblokaatorite hüpotensiivse toime suurenemist.
Suure hulga autorite tööd pakuvad andmeid üksikute neuroleptikumide seondumistugevuse (afiinsuse) kohta erinevat tüüpi neuroretseptoritega.
Kliinilises praktikas valdavalt kasutatavate tüüpiliste ja atüüpiliste antipsühhootikumide hulgast võib nende neurokeemilise toimeprofiili põhjal tinglikult jagada kuude rühma.
Esimesse rühma kuuluvad D2- ja D4-retseptorite selektiivsed blokaatorid (sulpiriid, amisudpriid, haloperidool jne) bensamiidi ja butürofenooni derivaatide rühmadest. Väikestes annustes, peamiselt presünaptiliste D4-retseptorite blokeerimise tõttu, aktiveerivad nad närviimpulsside dopamiinergilist ülekannet ja omavad stimuleerivat (disinhibeerivat) toimet, suurtes annustes blokeerivad nad D2-retseptoreid kõigis ajupiirkondades, mis avaldub kliiniliselt väljendunud antipsühhootilise toime, samuti ekstrapüramidaalsete ja endokriinsete (prolaktineemia tõttu) kõrvaltoimetena.
Teise rühma kuuluvad väga aktiivsed D2-retseptori blokaatorid, samuti ravimid, mis blokeerivad nõrgalt või mõõdukalt 5-HT2a- ja 5-HT1a-retseptoreid (flupentiksool, flufenasiin, zuklopentiksool jne), st peamiselt fenotiasiini piperasiini derivaadid või neile stereokeemilise struktuuri poolest lähedased tioksanteenid. Nagu esimese rühma ravimid, on ka nendel neuroleptikumidel ennekõike väljendunud antipsühhootiline (lõikev) toime ning need põhjustavad ka ekstrapüramidaalseid peavalunähte ja prolaktineemiat. Väikestes annustes on neil mõõdukalt aktiveeriv (psühhostimuleeriv) toime.
Kolmanda rühma moodustavad polüvalentsed sedatiivsed neuroleptikumid, mis blokeerivad enamiku neuroretseptoreid diferentseerimata viisil. Neil ravimitel on selgelt väljendunud blokeeriv toime dopamiiniretseptoritele ning need põhjustavad ka tugevat adrenolüütilist ja kolinolüütilist toimet. See hõlmab enamikku sedatiivseid neuroleptikume, peamiselt fenotiasiini alifaatseid ja piperidiini derivaate, samuti tioksanteene, mis on neile stereokeemilise struktuuri poolest lähedased (klorpromasiin, levomepromasiin, klorprotikseen jne). Nende ravimite psühhotroopse aktiivsuse spektris domineerib ennekõike väljendunud primaarne sedatiivne toime, mis tekib olenemata kasutatavast annusest, ja mõõdukas antipsühhootiline toime. Lisaks põhjustavad selle rühma ravimid oma väljendunud antikolinergilise toime tõttu nõrku või mõõdukaid ekstrapüramidaalseid ja neuroendokriinseid kõrvaltoimeid, kuid sageli viivad nad ortostaatilise hüpotensiooni ja muude autonoomsete reaktsioonide tekkeni, mis on tingitud α1-adrenergiliste retseptorite väljendunud blokaadist.
Neljandasse rühma kuuluvad neuroleptikumid, mis blokeerivad D2- ja 5-HT2a-retseptoreid tasakaalustatult, st samal määral (viimast veidi suuremal määral) ja α1-adrenoretseptoreid mõõdukal määral. Sellesse rühma kuuluvad uue põlvkonna atüüpiliste antipsühhootikumide (risperidoon, ziprasidoon, sertindool) esindajad, millel on erinev keemiline struktuur. Neurokeemiline toimemehhanism määrab nende selektiivse mõju peamiselt aju mesolimbilistele ja mesokortikaalsetele piirkondadele. Lisaks selgelt väljendunud antipsühhootilisele toimele, ekstrapüramidaalsete kõrvaltoimete puudumisele või nõrgale avaldumisele (terapeutiliste annuste kasutamisel), nõrgale või mõõdukale prolaktineemiale ja mõõdukatele adrenolüütilistele omadustele (hüpotensiivsed reaktsioonid) on see neuroleptikumide rühm võimeline korrigeerima negatiivseid sümptomeid, stimuleerides kaudselt dopamiinergilist ülekannet ajukoores.
Viiendasse rühma kuuluvad tritsüklilise dibensodiasepiini või sarnase struktuuriga polüvalentsed atüüpilised antipsühhootikumid (kloasapiin, olansapiin ja kvetiapiin). Nii nagu kolmanda rühma ravimid, blokeerivad need enamikku neuroretseptoreid diferentseerimata viisil. 5-HT2a retseptorid blokeeritakse aga tugevamalt kui D2 ja D4 retseptorid, eriti need, mis asuvad nigrostriataalses piirkonnas. See määrab ekstrapüramidaalse efekti tegeliku puudumise või nõrga puudulikkuse ning neuroendokriinsete kõrvaltoimete puudumise, mis on seotud prolaktiini produktsiooni suurenemisega, millel on selgelt väljendunud antipsühhootiline toime ja võime vähendada negatiivsete sümptomite raskust. Lisaks on kõigil selle rühma ravimitel väljendunud adrenolüütilised ja antihistamiinikumid, mis määravad rahustava ja hüpotensiivse toime. Kloasapiinil ja olansapiinil on ka üsna väljendunud blokeeriv toime muskariiniretseptoritele ja need viivad kolinolüütiliste kõrvaltoimete tekkeni.
Seega on võime blokeerida postsünaptilisi dopamiinergilisi retseptoreid dopamiini sünteesi ja metabolismi kompenseeriva suurenemisega ainus ühine biokeemiline omadus kõigil nendes rühmades käsitletavatel neuroleptikumidel.
Kuuendasse rühma kuulub ainus atüüpiline antipsühhootikum aripiprasool, mis on ilmunud kodumaisele psühhofarmakoloogilisele turule suhteliselt hiljuti. See ravim on D2-dopamiini retseptorite osaline agonist ning toimib hüperdopamiinergilises olekus funktsionaalse antagonistina ja hüpodopamiinergilises profiilis funktsionaalse agonistina. Aripiprasooli selline ainulaadne retseptoriprofiil võimaldab vähendada selle kasutamisel ekstrapüramidaalsete häirete ja hüperprolaktineemia riski. Lisaks toimib aripiprasool 5-HT1a retseptorite osalise agonistina ja samal ajal on see 5-HT2a retseptorite antagonist. Eeldatakse, et selline interaktsioon retseptoritega viib serotoniini ja dopamiini süsteemide üldiselt tasakaalustatud toimimiseni, seega võib aripiprasooli toimemehhanismi nimetada dopamiini-serotoniini süsteemi stabiliseerimiseks.
Seega võimaldab praegune teadmiste tase neuroleptikumide neurokeemiliste toimemehhanismide kohta pakkuda välja uue, patogeneetiliselt põhjendatuma farmakodünaamilise klassifikatsiooni selle psühhotroopsete ravimite rühma kohta. Selle klassifikatsiooni kasutamine võimaldab meil suures osas ennustada konkreetse ravimi psühhotroopse aktiivsuse spektrit, tolerantsust ja tõenäolisi ravimite koostoimeid. Teisisõnu, ravimi neurokeemilise aktiivsuse tunnused määravad suuresti selle kliinilise aktiivsuse tunnused, mida tuleks kasutada konkreetse antipsühhootilise ravimi valimisel konkreetsele patsiendile.
Mis tahes neuroleptikumi globaalse antipsühhootilise toime efektiivsust hinnatakse nn kloorpromasiini ekvivalendi abil, mis võetakse kui 1. Näiteks haloperidooli kloorpromasiini ekvivalent on = 50. See tähendab, et 1 mg haloperidooli antipsühhootiline efektiivsus on võrreldav 50 mg kloorpromasiiniga. Selle näitaja põhjal on välja töötatud klassifikatsioon, mis näeb ette neuroleptikumide jaotamise kõrge (kloorpromasiini ekvivalent > 10,0), keskmise (kloorpromasiini ekvivalent = 1,0-10,0) ja madala (kloorpromasiini ekvivalent = 1,0) antipsühhootilise aktiivsusega, mida nimetatakse patentsuseks. Tüüpilised neuroleptikumid (esimese põlvkonna antipsühhootikumid) on kliinilises psühhofarmakoteraapias laialdaselt kasutatud peaaegu pool sajandit. Nende terapeutilise aktiivsuse spekter hõlmab:
- globaalne antipsühhootiline toime, mis seisneb võimes ühtlaselt ja diferentseeritult vähendada psühhoosi erinevaid ilminguid:
- primaarne rahustav (inhibeeriv) toime - ravimite võime kiiresti leevendada psühhomotoorset agitatsiooni;
- selektiivne, selektiivne antipsühhootiline toime, mis avaldub võimes mõjutada individuaalseid sümptomeid: deliirium, hallutsinatsioonid, ajamite pärssimine jne;
- aktiveeriv (disinhibitoorne, disinhibitoorne, antiautistlik) neurotroopne toime, mis avaldub ekstrapüramidaalsete sümptomite tekkes;
- somatotroopne toime neuroendokriinsete ja vegetatiivsete kõrvaltoimete tekke näol;
- depressiivne toime, mis väljendub mõnede antipsühhootikumide võimes põhjustada depressioonisümptomeid.
Esimese põlvkonna antipsühhootikumide efektiivsus mitte ainult psühhootiliste häirete, vaid ka piiripealse psühhiaatrilise seisundi ravis on korduvalt tõestatud ja vaieldamatu. Seetõttu, hoolimata ravi kõrvaltoimete suurest esinemissagedusest nende väljakirjutamisel, kasutatakse neid meditsiinipraktikas jätkuvalt.
Atüüpilised antipsühhootikumid
Kaasaegsed juhised sisaldavad andmeid teise põlvkonna antipsühhootikumide kasutamise eeliste kohta farmakoteraapias. Mõiste "atüüpiline" (sünonüüm - teise põlvkonna antipsühhootikumid) on tingimuslik ja seda kasutatakse peamiselt uue põlvkonna tähistamise mugavuse huvides. Võrreldes traditsiooniliste neuroleptikumidega on selle rühma ravimid negatiivsete, afektiivsete ja kognitiivsete häirete korrigeerimisel efektiivsemad, millele lisandub parem talutavus ja väiksem ekstrapüramidaalsete sümptomite risk. Erinevusi ühe või teise ravimi terapeutilise toime olemuses atüüpiliste antipsühhootikumide seeriast selgitatakse, nagu ka tüüpiliste neuroleptikumide rühmas, selle individuaalse farmakoloogilise toime profiiliga.
Atüüpiliste antipsühhootikumidega psühhofarmakoteraapia võimaluste selgitamiseks on soovitatav keskenduda selle rühma Venemaal registreeritud ravimitele.
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
Klosapiin (dibensodiasepiin)
Atüüpiliste antipsühhootikumide rühma asutaja. Klosapiini toimemehhanismi iseloomustab D2-retseptorite kerge blokeerimine koos samaaegse kõrge antagonismiga 5-HT2a, a1-, a2-adrenergiliste ja H1-histamiiniretseptorite suhtes. See on osutunud efektiivseks antipsühhootikumiks teiste antipsühhootikumide (reservrühma ravim) suhtes resistentsuse korral ning on näidustatud ka kroonilise maania, psühhootilise agitatsiooni ja agressiivsuse raviks. Kodumaises praktikas määratakse kloasapiini sageli sedatsiooni saavutamiseks ja uinutina psühhootilistele patsientidele. Tuleb tunnistada, et kloasapiini selline kasutamine ei vasta selle peamistele näidustustele teraapias kasutamiseks. Tõenäoliselt tuleks suhtumist sellesse antipsühhootikumi kui teisejärgulise tähtsusega ravimisse muuta, kuna tänapäeval on see ainus ravim, millel on tõestatud efektiivsus resistentsete patsientide puhul.
Erinevalt tüüpilistest neuroleptikumidest ei põhjusta kloasapiin tõsiseid ekstrapüramidaalseid häireid, mis on tingitud eelmainitud madalast afiinsusest O2 retseptorite suhtes. Samuti selgus, et seda saab kasutada hilise düstoonia ja raske akatiisia raviks. NMS-i tekke madala riski tõttu võib kloasapiini pidada valikravimiks patsientidel, kes on varem selle tüsistuse all kannatanud.
Siiski võib kloasapiinravi ajal tekkida mitmeid tõsiseid kõrvaltoimeid. Neist kõige ohtlikum (isegi väikeste annuste korral) on agranulotsütoos, mis esineb 0,5–1,0% patsientidest. Muud olulised kõrvaltoimed, mis ravimi kasutamisel võivad esineda, on unisus, hüpersalivatsioon ja kehakaalu tõus, mis on kloasapiini määramise ajaks varasema antipsühhootilise ravi mõjul sageli juba suurenenud. Tähelepanu tuleks pöörata ka tahhükardia, arteriaalse hüpotensiooni ja epilepsiahoogude tekkimise võimalusele selle võtmise ajal. Krampide tõenäosus sõltub annusest. Nende risk suureneb oluliselt, kui kloasapiini annus ületab 600 mg päevas. Krampide teke ei ole ravimi edasise kasutamise vastunäidustus, kuid nõuab annuse poole võrra vähendamist ja krambivastaste ravimite, näiteks valproehappe, määramist. Kloasapiinravi kõrvaltoimete ennetamine hõlmab valgete vereliblede arvu, samuti EKG ja endokriinsete parameetrite hoolikat jälgimist.
Klosapiini üledoos võib põhjustada teadvuse langust kuni kooma tekkeni, samuti kolinolüütilise toimega seotud sümptomeid (tahhükardia, deliirium), epilepsiahooge, hingamisdepressiooni, ekstrapüramidaalseid sündroome. Üle 2500 mg annuse võtmisel võib tekkida surmav tulemus.
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
Risperidoon
Bensisoksasooli derivaat, millel on kõrge afiinsus serotoniini ja dopamiini Dj retseptorite suhtes ning domineeriv toime serotoniinisüsteemile. Ravimil on lai valik näidustusi, sealhulgas ägenemiste leevendamine, retsidiivide vastane ravi, esimese psühhootilise episoodi ravi ja skisofreenia negatiivsete sümptomite korrigeerimine. On näidatud, et ravim parandab skisofreeniaga patsientide kognitiivset funktsiooni. Esialgsed andmed on näidanud, et risperidoon vähendab ka skisofreeniaga patsientidel kaasuvaid afektiivseid sümptomeid ja võib olla valitud ravim bipolaarsete afektiivsete häirete ravis.
Risperidoonravi kõrvaltoimed, eriti ekstrapüramidaalsed häired, on annusest sõltuvad ja esinevad sagedamini annuste korral, mis ületavad 6 mg/päevas. Muude kõrvaltoimete hulka kuuluvad iiveldus, oksendamine, ärevus, unisus ja prolaktiini taseme tõus seerumis. Risperidooni pikaajaline kasutamine võib põhjustada kehakaalu tõusu ja II tüüpi diabeedi teket, kuid väiksema tõenäosusega võrreldes kloasapiini või olansapiiniga.
Üleannustamine võib põhjustada unisust, epilepsiahooge, QT-intervalli pikenemist ja QRS-kompleksi laienemist ning arteriaalset hüpotensiooni. On kirjeldatud risperidooni üledoosist tingitud surmaga lõppenud juhtumeid.
Ravimi vaieldamatu eelis on vedelate ja kiiresti lahustuvate (keelealuste) vormide kättesaadavus, mille kasutamine kiirendab ravimi sisenemist patsiendi organismi ja hõlbustab selle tarbimise kontrolli. Samuti on ravimil pikaajaline vorm - pulber intramuskulaarseks manustamiseks mõeldud suspensiooni valmistamiseks (konsta-risperidoon mikrosfäärides). Seda soovitatakse skisofreeniaga patsientide säilitusraviks, eriti patsientidele, kellel on halb ravijärgimine. Tuleb arvestada asjaoluga, et ravimi vereringesse jõudmiseks kulub umbes kolm nädalat, mistõttu peab patsient konsta-risperidoonravi alustamisel võtma lisaks risperidooni suukaudset vormi vähemalt 3 nädala jooksul pärast esimest süsti.
Olansapiin
Farmakoloogilise toime poolest on see lähedane kloasapiinile, kuna sellel on pleiomorfne retseptoriprofiil, millel on märkimisväärne afiinsus serotoniini, muskariini, α1-adrenergiliste ja histamiini retseptorite suhtes. Olansapiini terapeutiline aktiivsus sarnaneb kloasapiini ja risperidooni efektiivsusega skisofreenia positiivsete, negatiivsete ja depressiivsete sümptomite osas. Samal ajal on saadud andmeid olansapiini suurema efektiivsuse kohta võrreldes teiste atüüpiliste antipsühhootikumidega patsientidel, kellel on esimene psühhootiline episood, ja kognitiivse funktsiooni näitajate korrigeerimisel. Tuleb arvestada, et ravi alguses tabletivormis võib ilmneda kiire disinhibeeriv toime koos suurenenud psühhomotoorse agitatsiooni ja ärevusega. Seetõttu on raske psühhomotoorse agitatsiooniga kaasnevate hoogude ravis näidustatud ravimi süstitava vormi kasutamine.
Olansapiin põhjustab harva ekstrapüramidaalseid häireid või tardiivset düskineesiat ning selle kasutamise kõige sagedasemad kõrvaltoimed on ainevahetushäired ja kehakaalu tõus. On kindlaks tehtud, et olansapiini saavatel patsientidel esineb üsna sageli kolesterooli ja plasma lipiidide taseme tõusu ning eelsoodumus II tüüpi suhkurtõve tekkeks, kuid sellised kõrvalmõjud olid võrdselt levinud nii olansapiini kui ka kloasapiini saanud patsientidel. Samal ajal on saadud andmeid, mis näitavad, et kehakaalu tõus korreleerub positiivse ravivastusega olansapiinile (st on oluline ravi prognostiline näitaja) ja areneb rasvumiseks ainult 20–30% patsientidest, kes on ravi ajal ülekaalus juurde võtnud.
Üleannustamine võib põhjustada sedatsiooni, toksilisi antikolinergilisi toimeid, epilepsiahooge ja arteriaalset hüpotensiooni. Praegu puuduvad veenvad andmed üledoosist tingitud surma riski hindamiseks.
Kvetiapiin
See klassifitseeritakse dibensotiasepiini ühendiks. Selle retseptoriprofiil on suures osas sarnane klosapiini omaga. Kvetiapiini seondumismäär D2-retseptoritega on madal (alla 50%) ja lühiajaline isegi suurte annuste kasutamisel. Ravim on efektiivne skisofreenia positiivsete, negatiivsete ja üldiste sümptomite ravis. On tõendeid selle eduka kasutamise kohta nii raviresistentsuse korral kui ka patsientide kognitiivse funktsiooni parandamiseks, mis annab õiguse soovitada seda esmavaliku antipsühhootikumina skisofreenia säilitusravis. Lõpuks on kvetiapiinil mõõdukas antidepressantne, aktiveeriv toime. Seetõttu on see näidustatud depressiivsete-luuluste hoogude ja senesto-hüpohondrilise ringi häirete ravis.
Kvetiapiini väljakujunenud kõrge tümotroopne aktiivsus selgitab asjaolu, et see on registreeritud depressioonihäirete leevendamise ja sekundaarse ennetamise vahendina. I ja II tüüpi bipolaarsete häirete maniakaalsete episoodide raviks kasutatakse kvetiapiini täiendava vahendina. Süstevormide puudumine piirab mõnevõrra selle kasutamist agitatsiooni ja agressiivse käitumisega patsientidel.
Kvetiapiin on hästi talutav, see praktiliselt ei põhjusta ekstrapüramidaalseid sündroome, välja arvatud juhtudel, kui kasutatakse maksimaalseid annuseid. Kvetiapiin ei põhjusta hüperprolaktineemiat, harvemini kui olansapiin ja kloasapiin viib see kehakaalu tõusuni ja glükoositaluvuse halvenemiseni.
Ziprasidoon
Omab ainulaadset retseptori aktiivsuse profiili. Olles tugev 5HT2a ja D2 retseptorite antagonist, on see ka serotoniini ja norepinefriini tagasihaarde aktiivne inhibiitor. Kliinilised uuringud on näidanud ziprasidooni olulist paremust psühhootiliste sümptomite ja agressiivsuse ilmingute osas võrreldes haloperidooliga. Samuti on andmeid ziprasidooni positiivse mõju kohta skisofreeniaga patsientide kognitiivsetele funktsioonidele, samuti kaasuvatele afektiivsetele sümptomitele ja sotsiaalse funktsioneerimise näitajatele. Ziprasidoon on tavaliselt hästi talutav ja põhjustab väga harva ekstrapüramidaalseid sündroome, kehakaalu tõusu ja ainevahetushäireid. Sagedamini esineb QT-intervalli pikenemist üle 460 ms, seetõttu on seda ravimit saavatel patsientidel soovitatav teha EKG-uuring nii enne ravimi väljakirjutamist kui ka ravi ajal kontrollmonitooring. Erilist tähelepanu tuleks pöörata samaaegsele ravile (antiarütmikumide võtmine), mis võib süvendada QT-intervalli pikenemist ja viia südame rütmihäirete, vatsakeste virvenduse tekkeni.
Sertindool
Kuulub fenüülindooli derivaatide hulka. Sellel on kõrge funktsionaalne antagonism D2-, serotoniini (eriti 5-HT2a-retseptorite) ja a1-adrenergiliste retseptorite suhtes. Elektroneurokeemiliste uuringute kohaselt inhibeerib sertindool selektiivselt dopamiini retseptoreid ventraalses segmentaalses piirkonnas. Selline selektiivsus tagab suure tõenäosusega ravimi kasutamisel madala ekstrapüramidaalsündroomide ja hüperprolaktineemia riski. Võrdlevate uuringute tulemused on näidanud, et sertindool on antipsühhootilise toime poolest võrreldav haloperidooliga. Ravimil on väljendunud disinhibeeriv toime negatiivsete ja depressiivsete sümptomitega patsientidele, mis on parem kui rispolepti sarnane toime. Samuti on tõendeid, mis kinnitavad sertindooli efektiivsust kognitiivsete häirete korrigeerimisel skisofreeniaga patsientidel. Sertindool on patsientide poolt üldiselt hästi talutav, põhjustab harva sedatsiooni ja seetõttu on seda soovitatav asendusravimina, kui teiste kaasaegsete antipsühhootikumidega ravi ajal tekivad kõrvaltoimed.
Tõsiste kõrvaltoimete hulka kuulub ravimi võime pikendada QT-intervalli, mis võib viia südame rütmihäireteni. Turustamisjärgsete uuringute analüüsimisel selgus, et sertindooli südameprofiil ei erine teiste uue põlvkonna antipsühhootikumide omast.
Aripiprasool
Sellel on antipsühhootiline toime, mis on võrreldav teiste atüüpiliste ainetega, kuid sellel on suurem mõju skisofreeniaga patsientide kognitiivse funktsiooni parameetritele. Ravimi eespool mainitud ainulaadne farmakoloogiline toime - D2-retseptorite osaline agonist - võimaldab selle kasutamisel vähendada ekstrapüramidaalsete sündroomide ja hüperprolaktineemia riski.
 [ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
[ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
Amisulpriid
Kuulub asendatud bensamiidide klassi. Ravim seondub selektiivselt D2 ja D3 dopamiinergiliste retseptorite alatüüpidega, ei oma afiinsust D1, D4 ja D5 alatüüpide, samuti serotoniini, H1-histamiini, α1-adrenergiliste ja koliinergiliste retseptorite suhtes. Suurtes annustes kasutamisel blokeerib see postsünaptilisi D2 retseptoreid. Väikestes annustes avaldub selle disinhibeeriv toime presünaptiliste D2 ja D3 retseptorite blokeerimise tõttu, mistõttu on selle kasutamine efektiivne ka negatiivsete sümptomite ravis, kuigi see ei ole D2 ja serotoniini retseptorite kombineeritud antagonist. Mitmete uuringute tulemused näitavad ravimi väljendunud antipsühhootilist aktiivsust suurtes annustes kasutamisel, mis on parem kui traditsioonilistel ravimitel.
 [ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
[ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
Antipsühhootilise ravi kõrvaltoimed
Tabelis on loetletud atüüpilise antipsühhootikumiravi peamised kõrvaltoimed.
Ettevalmistus |
Ekstrapüramidaalsed |
Juhtivushäire EKG-l |
Ainevahetushäired (kaalutõus, glükoosi, kolesterooli ja triglütseriidide taseme tõus veres) |
||
Klosapiin |
. |
++ |
++ |
++- |
|
Risperidoon |
++ |
+/- |
++ |
+/- |
|
Olansapiin |
+ |
+/- |
+++ |
++ |
+++ |
Kvetiapiin |
+/- |
+ |
+/- |
--- |
|
Ziprasidoon |
+ |
++ |
+/- |
+/- |
+/- |
Sertindool |
++ |
-- |
+/- |
-- |
|
Ariliprasool |
-- |
--- |
+/- |
-- |
-- |
Amisulpriid |
++ |
+/- |
|||
Märkus. Kõrvaltoimete raskusaste: "+++" - kõrge; "++" - keskmine; "+" - madal; "+/-" - küsitav; "-" - puudub.
Ekstrapüramidaalsed sündroomid
Üks atüüpiliste antipsühhootikumide peamisi omadusi, erinevalt traditsioonilistest, on nende madal võime põhjustada ekstrapüramidaalseid sündroome, mis sai läbimurdeks skisofreenia säilitusravis. Kuid nagu tabeli andmetest nähtub, võivad selle seeria üksikute ravimite (risperidoon, amisulpriid) kasutamisel esineda sellised sümptomid, mis vajavad nende väljakirjutamisel erilist tähelepanu.
 [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
EKG kõrvalekalded
Mõnede kaasaegsete antipsühhootikumide kasutamisel teraapias on tõsine probleem kardiaalsete kõrvaltoimete tekkimise võimalus. Sellistel juhtudel räägime QT-intervalli pikenemisest, mis võib viia arütmia tekkeni. Juhtivushäireid, eelkõige QT-intervalli pikenemist, täheldatakse kõige sagedamini kloasapiini, sertindooli ja ziprasidooniga ravi ajal. Kaasnev patoloogia bradükardia, atrioventrikulaarne blokaad ja hüpotüreoidism võivad selle tüsistuse tekkele kaasa aidata ülalmainitud ravimitega ravi ajal. Praegu on EKG-monitooringut soovitatav umbes iga 3 kuu tagant patsientidel, kes saavad säilitusravi atüüpiliste antipsühhootikumidega.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
Endokriinsed häired
Praegu tekitab suurimat muret atüüpiliste antipsühhootikumide võime põhjustada kehakaalu tõusu. Suurenenud kehakaal, glükoosi ja triglütseriidide tase veres võivad põhjustada ainevahetushäireid ja II tüüpi diabeedi teket. Klosapiini ja olansapiinravi ajal on vajalik eriline ettevaatus ja biokeemiliste parameetrite iganädalane jälgimine. J. Geddes jt (2000), PB Jonesi, P. F. Buckley (2006) sõnul tuleks enne konkreetse tänapäevase põlvkonna antipsühhootikumi väljakirjutamist pidada vajalikuks läbi viia patsientide põhjalik uuring, kuna on teada, et ainevahetushäired esinevad sagedamini patsientidel, kellel oli enne ravi algust pärilik eelsoodumus, liigne kehakaal, lipiidide spektri häired ja hüperglükeemia. P. B. Jonesi, P. F. Buckley (2006) pakutud jälgimisalgoritm sisaldab mitmeid punkte.
- Ainevahetushäirete riskiga seotud haigusloo ja perekondlike tegurite kogumine.
- Kehamassiindeksi, EKG, vererõhu ja pulsi registreerimine enne ravi alustamist.
- Laboratoorsete andmete (glükoos, lipiidide profiil, kolesterool) kogumine enne ravi alustamist.
- Ravi ajal on vajalik regulaarne kehamassiindeksi ja elutähtsate näitajate jälgimine.
- Laboratoorsete andmete jälgimine ravi ajal.
Hüperprolaktineemia esinemine antipsühhootilise ravi ajal on tingitud hüpotalamuse dopamiiniretseptorite tsentraalsest blokaadist, mis viib prolaktiini vabanemiseni hüpofüüsi eessagarast. Hüperprolaktineemia tekib kõige sagedamini olansapiini, risperidooni ja amisulpriidiga ravimisel.
 [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
[ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
Agranulotsütoos
Teine tõsine antipsühhootilise ravi tüsistus. Seda võib täheldada kloasapiini ja olansapiiniga ravi ajal. J. Geddes jt (2000) andmetel diagnoositi see esimese 3 kuu jooksul 1-2%-l neid ravimeid võtvatest patsientidest. Sellega seoses on soovitatav teha iganädalasi vereanalüüse patsientidele, kes võtavad neid ravimeid esimese 18 ravinädala jooksul, ja seejärel igakuist jälgimist. On näidatud, et kui eespool nimetatud neuroleptikumide annust vähendatakse, normaliseerub kliiniline vereanalüüs. Samal ajal tuleb tunnistada, et tänaseni puudub selge strateegia patsientidele, kellel esinevad eespool nimetatud ainevahetushäiretega seotud kõrvaltoimed. Enamasti asendatakse üks atüüpiline antipsühhootikum teisega. Teine paljutõotav suund on spetsiaalse korrigeeriva ravi määramine, eelkõige bromokriptiini kasutamine hüperprolaktineemia korrigeerimiseks. Ideaalne olukord on see, kus selliste häiretega patsiendi ravi toimub internide, eelkõige endokrinoloogide, kardioloogide ja teiste spetsialistide perioodilise kaasamisega.
Kokkuvõtteks tuleb märkida, et kui järgitakse antud algoritme mitte ainult patsientide vaimse, vaid ka füüsilise seisundi määramiseks ja jälgimiseks, on teise põlvkonna ravimite kasutamine ohutum kui tüüpilised neuroleptikumid.
Mitmed teised antipsühhootikumid on praegu arendusjärgus. Järgmise põlvkonna ravimitel on tõenäoliselt erinev toimemehhanism (näiteks GABAergiline profiil) ja need suudavad mõjutada skisofreenia mitmesuguseid ilminguid, sealhulgas defitsiidihäireid ennast.
Tähelepanu!
Teabe tajumise lihtsustamiseks tõlgendatakse seda juhendit ravimi "Neuroleptikumid ehk antipsühhootikumid " kasutamiseks ja esitatakse erilisel kujul ravimite meditsiinilise kasutamise ametlike juhiste alusel. Enne kasutamist lugege otse ravimile lisatud märkust.
Kirjeldus on esitatud informatiivsel eesmärgil ja see ei ole juhend enesehoolduseks. Selle ravimi vajadust, raviskeemi eesmärki, ravimeetodeid ja annust määrab ainult raviarst. Enesehooldus on teie tervisele ohtlik.

