Artikli meditsiiniline ekspert
Uued väljaanded
Marutaud lastel
Viimati vaadatud: 04.07.2025

Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
Marutaud ehk hüdrofoobia on äge viirushaigus, mis levib nakatunud looma hammustuse kaudu, millega kaasneb närvisüsteemi kahjustus ja raske entsefaliidi teke surmaga lõppeva tulemusega.
Epidemioloogia
Marutaudviirus, mis on rahvatervise nuhtlus juba iidsetest aegadest, põhjustab praegu igal aastal ligikaudu 59 000 inimese surma, millest peaaegu kõik on levinud koerahammustuste kaudu. Sellel on märkimisväärne majanduslik mõju arengumaadele, eriti Aafrikas ja Aasias, mis suudavad selliseid kaotusi kõige vähem kanda. Vaatamata peaaegu 100% suremuse määrale on koerte marutaud siiski täielikult ennetatav haigus ja ajaloolised näited koerte marutaudi likvideerimisest arenenud riikides kinnitavad seda. [ 1 ]
Põhjused marutaud
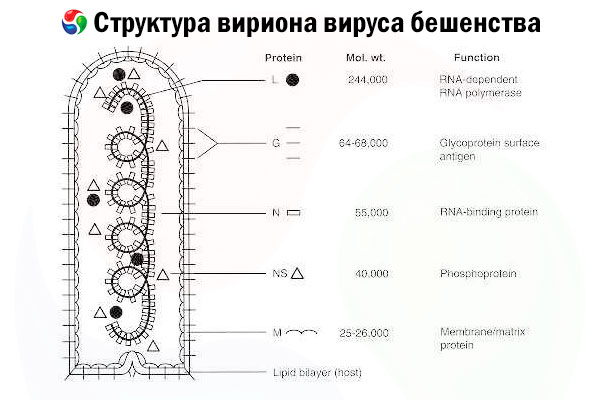
Haigustekitaja on marutaudiviirus (RV), mis on rabdoviiruste perekonda kuuluv negatiivse ahelaga RNA-viirus, mille suurus on ligikaudu 60 nm × 180 nm.
See koosneb sisemisest valgusüdamikust ehk nukleokapsiidist, mis sisaldab nukleiinhapet, ja välismembraanist, lipiide sisaldavast kaksikkihist, mis on kaetud transmembraansete glükoproteiinide ogadega. Sellel on suhteliselt lihtne modulaarne genoomistruktuur ja see kodeerib viit struktuurvalku:
- RNA-sõltuv RNA polümeraas (L),
- nukleoproteiin (N),
- fosforüülitud valk (P),
- maatriksvalk (M) ja
- välispinna glükoproteiin (G).
N-, P- ja L-valgud moodustavad koos genoomse RNA-ga ribonukleoproteiinide kompleksi. G on ainus RV-antigeen, mis on võimeline indutseerima RV-d neutraliseerivate antikehade tootmist, mis on peamised immuunsüsteemi efektorid surmava RV-nakkuse vastu. Teisest küljest on näidatud, et ribonukleoproteiinide kompleks on peamine RV-antigeen, mis on võimeline indutseerima CD4+ T-rakke, mis võivad suurendada RV-d neutraliseerivate antikehade tootmist intrastruktuurilise antigeeni äratundmise kaudu.[ 2 ] Ribonukleoproteiinide kompleksil võib olla oluline roll immunoloogilise mälu ja pikaajalise immuunsuse loomisel.[ 3 ]
Klassifikatsioon ja antigeenitüübid
Perekonda Lyssavirus kuuluvad marutaudiviirus ning antigeenselt ja geneetiliselt seotud marutaudiviirused: Lagose, Mokola ja Duvenhage'i nahkhiireviirused, samuti kaks oletatavat Euroopa nahkhiire lüssaviiruste alatüüpi. Ristkaitse uuringud näitavad, et traditsiooniliste marutaudivaktsiinidega immuniseeritud loomad ei pruugi olla täielikult kaitstud, kui neid nakatatakse teiste lüssaviirustega.
Marutaudiviiruseid saab liigitada fikseeritud (loomadel või rakukultuuris passaaži teel kohandunud) ja tänavaviiruseteks (metsiktüüp). Monoklonaalsete antikehade ja geneetilise sekveneerimise kasutamine tänavaviiruse eristamiseks on aidanud tuvastada viiruse variante, mis pärinevad peamistest peremeesorganismide reservuaaridest kogu maailmas, ja viidata tõenäolistele inimeste kokkupuuteallikatele juhtudel, kui patsiendil puudus muul viisil kindel loomahammustus.[ 8 ]
Pathogenesis
Metsloomade peamine nakkusallikas ja reservuaar on hundid, rebased, šaakalid, nahkhiired ning koduloomade seas koerad ja kassid, harva hobused, veised, sead, rotid jne. Nakkuse levik inimeselt inimesele on küll võimalik, kuid äärmiselt haruldane. See on tüüpiline zoonoosne infektsioon. Inimesed nakatuvad marutaudi peamiselt koertelt.
Pärast seda, kui haige loom hammustab inimest, paljuneb viirus hammustuskoha lihaskoes ning seejärel, olles jõudnud sensoorsete perifeersete närvide otsteni, levib tsentripetaalselt, jõudes motoorsete neuroniteni. Aeg, mis kulub viiruse liikumiseks ja aju mõjutamiseks, sõltub hammustuse kohast. Pea ja näo raskete hammustuste korral võib viirus jõuda kesknärvisüsteemi 15–20 päevaga ning kere ja jäsemete naha väiksemate kahjustuste ja sellest tulenevalt väikese patogeeni annuse korral võib viiruse kesknärvisüsteemi liikumine edasi lükkuda mitu kuud või isegi kuni 1–1,5 aastat. Kesknärvisüsteemi jõudnud viirus kinnistub pea- ja seljaaju kudedes, peamiselt medulla oblongata neuronites, Ammoni sarves ja ajupõhjas. Seljaajus on enim mõjutatud tagumised sarved. Kesknärvisüsteemist jõuab viirus tsentrifugaalselt mööda närvitüvesid süljenäärmetesse, kus see paljuneb ja eritub süljega.
Marutaudide patogeneesi kontseptsioonid
RV-l on lai peremeesorganismide ring ja see võib nakatada peaaegu kõiki imetajaid. Kuigi on teatatud mitmest RV edasikandumise viisist, toimub loomulik nakatumine kõige sagedamini hammustuse kaudu. Lisaks hammustustele võib RV-ga nakatunud korjuste söömine soodustada marutaudiviiruse nakatumist polaarrebastel ning RV kokkupuude limaskestadega on leitud olevat veel üks võimalik edasikandumise tee.[ 9 ] Mõningatel ebatavalistel asjaoludel, näiteks RV juhuslikul aerosooli kujul laboris või RV aerosoolina koobastes, kus elab suur hulk nahkhiiri,[ 10 ] võib esineda aerosooli ülekannet.
Pole veel selge, kas tänava-RV ja hiirega kohandatud või koekultuuriga kohandatud RV tüved paljunevad inokuleerimiskohas enne kesknärvisüsteemi sisenemist. Kuigi noorte hamstrite või kährikute eksperimentaalne intramuskulaarne nakatumine tänava-RV-ga näitas RV replikatsiooni vöötlihasrakkudes enne, kui viirus tungis motoorsete neuronite aksonitesse läbi neuromuskulaarsete ühenduskohtade,[ 11 ][ 12 ] näitas hiirte intramuskulaarne nakatumine hiirega kohandatud CVS-24 RV-ga, et RV migreerub otse kesknärvisüsteemi ilma eelneva replikatsioonita inokuleerimiskohas.[ 13 ] Kui RV on jõudnud müeliniseerimata aksonite otstesse, transporditakse see retrograadselt rakukehasse.
Hiljutised leiud viitavad sellele, et aksonite vesiikulite transport võib olla võtmestrateegia virionide pikamaa liikumiseks aksonites.[ 14 ] On hinnatud, et RV migreerub aksonites kiirusega 3 mm/h.[ 15 ] Seejärel levib infektsioon läbi neuronite ahela, mis on ühendatud sünaptiliste ühenduskohtadega. Täpne mehhanism, mis soodustab transsünaptilist levikut, on aga siiani teadmata. Pärast aju nakatumist levib viirus tsentrifugaalselt perifeersesse ja autonoomsesse närvisüsteemi paljudes perifeersetes organites.[ 16 ] Infektsioonitsükli viimases etapis migreerub RV süljenäärmetesse; pärast paljunemist mukogeensetes atsinaarrakkudes vabaneb see sülje ja on valmis edasikandumiseks järgmisele peremeesorganismile.[ 17 ]
Seoses marutaudiviiruse poolt esilekutsutud patoloogiaga on eksperimentaalsetes marutaudimudelites hiirtel, kes on nakatunud kindla RV tüvega, pakutud potentsiaalse patogeense mehhanismina välja apoptootiline rakusurm.[ 18 ] Patogeenne mehhanism, mis võib kaasa aidata marutaudile iseloomulikule sügavale KNS-i düsfunktsioonile, võib olla neuronite funktsiooni häire. On näidatud, et geeniekspressioon on RV-ga nakatunud neuronites märkimisväärselt vähenenud, mille tulemuseks on valgusünteesi üldine pärssimine,[ 19 ] ja mitmed uuringud on näidanud neurotransmissiooni häireid pärast RV-nakkust. Jiang näitas, et atsetüülkoliini retseptori antagonisti seondumine nakatunud roti aju homogenaatidega oli kontrollrühmaga võrreldes vähenenud.[ 20 ] RV-ga nakatunud roti ajus täheldati ka serotoniini, unetsükli, valu tajumise ja käitumise kontrollimises osaleva neurotransmitteri, vabanemise ja seondumise häireid.[ 21 ],[ 22 ] Lisaks neurotransmissiooni mõjutamisele võib parema vatsakese infektsioon mõjutada ka ioonkanaleid. Nakatunud hiire neuroblastoomirakkudel on pingega juhitavate naatriumikanalite funktsionaalse ekspressiooni vähenemine, mis võib takistada aktsioonipotentsiaalide teket ja lõpuks viia funktsionaalse kahjustuseni.[ 23 ]
Lisaks tõsiste patoloogiliste kahjustuste puudumisele KNS-is ei tekita enamik inimeste marutaudi juhtumeid immuunvastust 7–10 päeva pärast kliiniliste tunnuste ilmnemist. Neid olulisi erinevusi marutaudi patogeneesi ja enamiku teiste viiruslike või bakteriaalsete KNS-i infektsioonide vahel toetab veelgi asjaolu, et immunosupressioon on kas ebaefektiivne või kahjustab marutaudi ravi tulemust.[ 24 ] Marutaudihaigetel sageli täheldatav madal immuunvastuse tase on hämmastav, sest seda ei saa seletada RV-antigeenide nõrga immunogeensusega. Tegelikult on RV G ja nukleokapsiidi valk parenteraalselt manustatuna tugevad B- ja T-rakkude antigeenid.[ 25 ] Võimalik seletus RV-vastase madala immuunvastuse tasemele inimestel või marutaudihaigetel loomadel võib olla see, et KNS-i RV-nakkus põhjustab immunosupressiooni [ 26 ] ning on oletatud, et RV kasutab õõnestavat strateegiat, mis hõlmab apoptoosi ennetamist ja sissetungivate T-rakkude hävitamist.[ 27 ]
Mitteneuronaalsete rakkudega kohanenud nõrgestatud RV-tüved erinevad patogeensetest tänava-RV-tüvedest oluliselt oma neuroinvasiivsuse poolest, mis viitab nende võimele tungida KNS-i perifeersetest kohtadest. Sellega seoses on koekultuuriga kohanenud RV-tüvedel kas puudub või on neil vaid piiratud võime tungida KNS-i perifeersetest kohtadest, samas kui tänava-RV-tüved või hiirega kohanenud RV-tüved, näiteks CVS-24, on väga invasiivsed.[ 28 ] RV neuroinvasiooni peamised tegurid on viiruse omastamine, aksonaalne transport, transsünaptiline levik ja viiruse replikatsioonikiirus.
Kuni viimase ajani olid meie teadmised RV patogeneesist piiratud ja põhinesid peamiselt tänaval levivate RV tüvede kirjeldavatel uuringutel või laboris kohandatud nõrgestatud tüvedega eksperimentaalsetel infektsioonidel. Pöördgeneetika tehnoloogia tulek on võimaldanud meil tuvastada viiruslikke elemente, mis määravad RV patogeense fenotüübi, ja paremini mõista marutaudi patogeneesis osalevaid mehhanisme.
Marutaudiviiruse omandamist, levikut ja paljunemist kontrollivate viiruselementide identifitseerimine
- Viiruse püüdmisega seotud viiruselemendid
RV-nakkus algab viiruse kinnitumisega oletatava rakulise retseptori külge. Kuigi RV-retseptoritena on pakutud välja mitmeid membraanipinna molekule, sealhulgas nikotiinhappe atsetüülkoliini retseptor,[ 29 ] närvirakkude adhesioonimolekul[ 30 ] ja madala afiinsusega neurotrofiini retseptor p75 NTR,[ 31 ] on endiselt ebaselge, kas need molekulid tegelikult mängivad rolli marutaudiviiruse elutsüklis. Selles kontekstis on hiljuti näidatud, et RV G ja p75 NTR interaktsioon ei ole primaarsete neuronite RV-nakkuse jaoks vajalik.[ 32 ] Pärast retseptoriga seondumist internaliseeritakse RV adsorptsioonilise või retseptori vahendatud endotsütoosi teel.[ 33 ] Endosomaalse sektsiooni madal pH-ga keskkond kutsub seejärel esile RV G konformatsioonilisi muutusi, mis käivitavad viirusmembraani fusiooni endosomaalse membraaniga, vabastades seeläbi RNP tsütoplasmasse.[ 34 ] Viiruste puhul mängib RV G kriitilist rolli viiruse omastamisel, tõenäoliselt interaktsioonide kaudu oletatavate rakuliste retseptoritega, mis hõlbustavad kiiret omastamist. Sellega seoses on tõestatud, et koekultuuris kohandatud RV tüvede (nt ERA, HEP ja CVS-11) patogeneesus korreleerub G-valgu antigeenses kohas III paikneva determinandi olemasoluga. [ 35 ] Arg → Gln mutatsioon positsioonil 333 selles ERA G-valgu antigeenses kohas põhjustas Gln333 RV variandi internaliseerimise seitsmekordse viivituse võrreldes metsiktüüpi variandiga. RV G mutatsioon Asn194→Lys194, mis selgitab patogeense fenotüübi taastekkimist, oli seotud internaliseerimisaja olulise lühenemisega.[ 36 ] Lisaks näitasid kimäärsete RV-dega tehtud katsed, et RV virionide internaliseerimiseks kuluv aeg pikenes oluliselt ja patogeensus vähenes tugevalt pärast seda, kui hõbedast saadud nahkhiirega seotud tüve RV-18 cDNA kloonist saadud kõrge patogeensusega SB RV tüve G geen [ 37 ] asendati kõrgelt nõrgestatud SN tüve omaga, mis eraldati SAD B19 RV vaktsiinitüve cDNA kloonist.[ 38 ] Kokkuvõttes toetavad need andmed arusaama, et viiruse omastamise kineetika, mis on RV G funktsioon, on RV patogeensuse peamine määraja.
- Viiruse leviku ja edasikandumisega seotud viiruselemendid
Marutaudviiruse ainulaadne omadus on selle võime levida rakust rakku. Tähelepanek, et Gln333 ERA variant kaotab in vitro pH-sõltuva rakkudevahelise fusiooni aktiivsuse [ 39 ] ja omab oluliselt vähenenud võimet rakust rakku levida [ 40 ], viitab sellele, et RV G mängib samuti võtmerolli rakkudevahelises levikus ja seega viiruse ülekandes, tõenäoliselt oma fusiogeense aktiivsuse kaudu. Seda võimalust toetab veelgi leid, et patogeense RV revertante SPBNGAK levikukiirus on peaaegu kaks korda suurem kui mittepatogeense SPBNGAK variandi puhul. Huvitaval kombel põhjustas Asn 194 → Lys 194 mutatsioon G SPBNGAK-s membraanfusiooni pH läve nihkumise kõrgema pH poole, mis toetab hüpoteesi, et kõrgem membraanfusiooni pH lävi on seotud viiruse suurenenud levikuga. [ 41 ]
RV-nakkuse transneuronaalsete indikaatorite uuringud rottidel [ 42 ] ja reesusahvidel [ 43 ] on näidanud, et marutaudiviirus migreerub aksonites ainult retrograadses suunas. Kuigi neuronite transpordimehhanismides osaleb mitu RV-valku, näib RV G mängivat domineerivat rolli RV-nakkuse transneuronaalses levikus. Näiteks kui hobuste nakkava aneemia viiruse (EIAV) perifeerne infektsioon, mille pseudotüüp on RV G, viib viiruse ülekandeni seljaaju, siis sama EIAV, mille pseudotüüp on vesikulaarse stomatiidi viirus G, ei sisenenud närvisüsteemi. [ 44 ] Lisaks leiti, et ERA G Arg 333 → Gln 333 mutandi viiruse levik KNS-is oli metsiktüüpi mutandiga võrreldes tugevalt vähenenud, mis viitab veelgi intaktse RV G funktsioonile transsünaptilises levikus. Kõige veenvam tõend RV G olulise rolli kohta transsünaptilises transpordis pärineb hiirte intrakraniaalsest nakatamisest rekombinantse G-defitsiidiga RV viirusega, mis näitas, et infektsioon piirdus neuronitega inokuleerimiskohas ilma igasuguste leviku tunnusteta sekundaarsetele neuronitele.[ 45 ] Siiski on tõenäoline, et lisaks RV G-le mängib viiruse levikus ja seega ka transsünaptilises transpordis rolli ka RV M. Sellega seoses näidati, et kimäärse SN-BMBG RV variandi, mis sisaldab nii M-i kui ka G-d kõrge patogeensusega SB-st, levik oli oluliselt suurem kui kimäärse SN-BG või SN-BM variandi levik, mis sisaldavad vastavalt SB-st pärit G-d ja M-i, mis viitab sellele, et M optimaalne interaktsioon G-ga võib mängida olulist rolli rakkudevahelises viiruse levikus. [ 46 ] Kuna RV M toetab viiruse pungumist, [ 47 ] on tõenäoline, et RV SN-BMBG kimäärse variandi efektiivsem levik on tingitud optimaalsest viiruse pungumisest postsünaptilises membraanis.
Hiljutised uuringud on näidanud, et RV P ja düneiini kerge ahela interaktsioon seob RV RNP peremeesraku transpordisüsteemiga, hõlbustades seeläbi viiruse retrograadset aksonaalset transporti.[ 48 ],[ 49 ] Täiskasvanud hiirte perifeerne infektsioon näitas aga, et RV P LC8 sidumisdomeeni deletsioon ei takista viiruse sisenemist KNS-i, mis viitab sellele, et RV valk ei ole otseselt seotud RV retrograadse aksonaalse levikuga.[ 50 ]
- Viiruse elemendid, mis kontrollivad viiruse replikatsiooni
Erinevalt paljudest teistest viirustest, näiteks gripiviirusest, on RV patogeneesus pöördvõrdeline viiruse RNA sünteesi kiiruse ja nakkuslike viirusosakeste tootmise kiirusega. Erinevate kimäärsete viiruste poolt toodetud viiruse mRNA ja genoomse RNA tasemete võrdlus viitab sellele, et viiruse RNA transkriptsiooni ja replikatsiooni reguleerivad mitmed tegurid, sealhulgas RV M, mis on identifitseeritud kui trans-toimeline faktor, mis vahendab üleminekut esialgselt kõrgelt mRNA sünteesi tasemelt genoomse RNA sünteesile.[ 51 ] Lisaks on kõigi rabdoviiruste M võimeline viiruse geenide ekspressiooni välja lülitama, seondudes RNP-ga, mille tulemuseks on väga kondenseerunud karkassitaolise struktuuri moodustumine, mis ei suuda RNA sünteesi toetada.
Et tuvastada teisi viiruselemente, mis kontrollivad patogeensust viiruse replikatsiooni reguleerimise kaudu, asendati kõrge patogeensusega SB tüve 5'-terminaalsed järjestused järk-järgult kõrgelt nõrgestatud SN-vaktsiinitüve järjestustega, mille tulemuseks olid rekombinantsed viirused SB2 (terminaalne järjestus [TS] + L), SB3 (TS + L + pseudogeen [Ψ]), SB4 (TS + L + Ψ + G) ja SB5 (TS + L + Ψ + G + M). Intramuskulaarne infektsioon algsete SB- ja SN-viirustega ning kimäärsete RV-dega SB2, SB3, SB4 ja SB5 kutsus esile kõrgeima suremuse SB-nakatunud hiirtel ning haigestumust ega suremust SN-nakatunud hiirtel ei esinenud. TS, L ja SB asendamine vastavate SN-elementidega vähendas haigestumust ja suremust mõõdukalt ning täiendav G või G pluss M vahetus vähendas oluliselt või kaotas täielikult viiruspatogeensuse.
Nende metsiktüüpi ja kimäärsete RV-de fenotüübiline iseloomustus koekultuuris näitas, et antud RV patogeneesus on pöördvõrdelises korrelatsioonis selle võimega neuronaalsetes rakkudes paljuneda. Kuigi SB replikeerus peaaegu 1000 korda madalamal tasemel kui SN ning TS, L ja SB-s asendamine SN tasemetega ei mõjutanud viiruse kasvukineetikat kuigi palju, põhjustas SB G või G pluss M täiendav asendamine vastavate SN geenidega viiruse tootmise 1-logaritmilise suurenemise, mis viitab sellele, et nii viiruse RNA replikatsioonikineetikat kui ka viirusosakeste tootmist kontrollib suures osas RV G-valk. Seda järeldust toetavad andmed, mis on saadud RV G variantidega, mille G-valgud erinevad üksteisest ühe aminohappe poolest. Patogeenne marutaudiviiruse variant SPBNGAK 194 tekitas NA rakkudes viiruse tiitri, mis oli 1 log võrra madalam kui mittepatogeense variandi SPBNGAK 194 tekitatud tiiter, ning reaalajas PCR-analüüs näitas, et viirusliku RNA transkriptsiooni ja replikatsiooni kiirused SPBNGAK-ga nakatatud NA rakkudes olid 5 ja 10 korda kõrgemad kui SPBNGAK-ga nakatatud NA rakkudes.[ 52 ] Täiendavaid tõendeid patogeensuse ja viirusliku RNA sünteesi kiiruse ning viirusosakeste tootmise vahelise pöördvõrdelise seose kohta said kimäärsete rekombinantsete viirustega nakatatud hiired, milles nõrgestatud SN-tüve G- ja M-geenid olid asendatud kõrge patogeensusega SB-tüve geenidega. Need katsed näitasid RV G-d kandva SN-tüve patogeensuse olulist suurenemist patogeense SB-tüvega võrreldes. Patogeensus suurenes veelgi, kui SN-i viidi nii G- kui ka M-geenid SB-st.
G või M või mõlema asendamine SN-is vastavate SB geenidega seostus viirusosakeste tootmise kiiruse ja viirusliku RNA sünteesi kiiruse olulise vähenemisega. Need andmed näitavad, et nii G kui ka M mängivad olulist rolli RV patogeneesis, reguleerides viiruse replikatsiooni. Leid, et G või G ja M asendamine SN-is G või G ja M-iga SB-s põhjustab vastavalt mõõdukat kuni tugevat viirusliku RNA transkriptsiooni ja replikatsiooni vähenemist, samas kui ainult M asendamine SN-is SB M-iga põhjustab viirusliku RNA transkriptsiooni ja replikatsiooni tugevat suurenemist, näitab, et RV G-l on samuti oluline regulatiivne funktsioon viirusliku RNA transkriptsioonis/replikatsioonis kas üksi või interaktsiooni kaudu M-valguga. Mehhanism, mille abil RV G geen kontrollib viirusliku RNA sünteesi, on teadmata. Teatud RV G geenide nukleotiidjärjestused, näiteks need, mis sisaldavad Arg333 ja Lys 194 koodoneid, on identifitseeritud rakuliste miRNA-de sihtmärkidena. On näidatud, et sihtmärkide äratundmine rakuliste miRNA-de poolt võib põhjustada viiruse replikatsiooni positiivset või negatiivset regulatsiooni. [ 53 ] Arg 333 → Glu 333 või Lys 194 → Ser 194 asendused RV G geeni järjestuses põhjustavad miRNA sihtjärjestuste kadumist, mis omakorda on seotud viirusliku RNA sünteesi kiiruse olulise suurenemisega [Faber M, Thomas Jeffersoni Ülikool, PA, USA, avaldamata andmed], mis viitab sellele, et peremeesraku miRNA-del on samuti oluline roll RV replikatsiooni regulatsioonis, nagu on näidatud ka teiste RNA viiruste, sealhulgas vesikulaarse stomatiidi viiruse ja HCV puhul. [ 54 ], [ 55 ]
Viiruse replikatsiooni regulatsioon näib olevat üks olulisi RV patogeneesis osalevaid mehhanisme. Immuunvastuse vältimiseks ja neuronaalse võrgustiku terviklikkuse säilitamiseks saavad patogeensed RV tüved, kuid mitte nõrgestatud tüved, reguleerida oma kasvukiirust. Madalam replikatsioonikiirus on tõenäoliselt patogeensetele RV tüvedele kasulik, säilitades neuronaalse struktuuri, mida need viirused kasutavad kesknärvisüsteemi jõudmiseks. Teine seletus patogeense RV madalamale replikatsioonikiirusele on see, et peremeesorganismi immuunsüsteemi poolt varajase avastamise vältimiseks säilitab viirus oma antigeenide minimaalse ekspressioonitaseme.
RV G ekspressiooni, apoptoosi ja patogeensuse seos
On hästi teada, et tänavamarutaudiviiruse tüved, mis on oluliselt patogeensemad kui koekultuuriga kohandatud tüved, ekspresseerivad väga piiratud koguses G-d ja ei indutseeri apoptoosi enne nakkustsükli lõppu, mis viitab sellele, et konkreetse viirustüve patogeneesus on pöördvõrdelises korrelatsioonis RV G ekspressiooni ja võimega indutseerida apoptoosi.[ 56 ] Otseseid tõendeid G ekspressiooni taseme ja apoptoosi ulatuse vahelise korrelatsiooni kohta saadi rekombinantse RV SPBNGA-GA abil, mis kandis kahte identset G geeni ja oli RV G üleekspresseeritud.[ 57 ] Selle rekombinantse RV-ga nakatatud neuronaalsete kultuuride morfoloogilised uuringud näitasid, et rakkude surm oli RV G üleekspressiooniga paralleelselt oluliselt suurenenud ja et apoptoos on peamine mehhanism, mis osaleb RV G vahendatud surmas. Eelkõige on F-aktiini värvumise vähenemine pärast SPBNGA-GA infektsiooni kooskõlas apoptoosi poolt indutseeritud aktiini filamentide depolümerisatsiooniga. Lisaks oli TUNEL-positiivsete tuumade arv SPBNGA-GA-ga nakatatud neuronites oluliselt suurenenud võrreldes nakatamata ja SPBNGA-ga nakatatud neuronitega. Siiski on mehhanism, mille abil RV G geen vahendab apoptootilist signaaliülekande protsessi, suures osas teadmata. On oletatud, et RV G ekspressioon üle teatud läve kahjustab oluliselt rakumembraani. On väga tõenäoline, et apoptootilised rakud ei elimineeru KNS-is kiiresti ja seetõttu läbivad nad sekundaarse nekroosi. [ 58 ] Teisest küljest võib RV-nakkus ja eriti RV G valgu üleekspressioon viia püroptoosini, mis on apoptoosiga sarnane rakusurma rada ja mis erinevalt apoptoosist hõlmab kaspaas 1 aktiveerimist ja viib seeläbi nekroosini. [ 59 ] RV-nakkuse poolt esile kutsutud nekroosi või püroptoosi aste mängib tõenäoliselt kriitilist rolli viirusevastase immuunsuse esilekutsumisel. Kuigi apoptootilised rakud säilitavad oma membraani terviklikkuse ega stimuleeri kaasasündinud immuunvastust, muutuvad nekrootilised rakud permeabiliseerituks ja eritavad endogeenseid adjuvante, mis võivad käivitada tugeva kaasasündinud immuunvastuse. [ 60 ]
Kuna apoptoosi/nekroosi tase korreleerub RV immunogeensusega, on oletatud, et apoptootiliste/nekrootiliste rakkude immunostimuleeriv toime aitab tõenäoliselt kaasa kaitsva immuunvastuse tekkele. Seetõttu on RV G ekspressiooni reguleerimine väga tõenäoliselt oluline tegur marutaudi patogeneesis, kuna see pakub vahendeid patogeensete RV variantide ellujäämiseks ja levikuks närvisüsteemis ilma ilmseid neuronaalseid kahjustusi põhjustamata ja kutsudes esile kaitsva immuunvastuse, mis ennetaks infektsiooni.
RV G ekspressiooni saab reguleerida RNA sünteesi tasemel, translatsioonijärgsel tasemel või mõlemal. On näidatud, et erinevate RV kimäärsete variantide poolt ekspresseeritud RV G tasemed kajastuvad viiruse RNA sünteesi kiiruses, mis viitab sellele, et RV G ekspressiooni erinev regulatsioon nende variantide poolt tuleneb viiruse mRNA transkriptsiooni kiiruse varieerumisest. Nagu viiruse RNA transkriptsiooni kiiruste puhul, on ka nende variantide poolt ekspresseeritud RV G hulk pöördvõrdelises korrelatsioonis viiruse patogeensusega. Teisest küljest andis primaarsete neuronaalsete kultuuride nakatumine vähem patogeense RV variandiga CVS-B2c tulemuseks neli korda kõrgema G-valgu taseme kui nakatumine kõrge patogeensusega variandiga CVS-N2c, hoolimata võrreldava G mRNA sünteesi tasemest mõlemas infektsioonis. Pulss-jälituskatsed näitasid, et CVS-B2c-ga nakatunud neuronite kõrgemad G-valgu tasemed olid suuresti tingitud CVS-B2c G-valgu madalamast lagunemiskiirusest võrreldes CVS-N2c G-valguga. Mehhanism, mis viib CVS-N2c G-valgu kiirema proteolüütilise lagunemiseni, on aga veel selgitamata.
Sümptomid marutaud
Marutaudist põhjustatud nakkuse inkubatsiooniperiood on keskmiselt 30–90 päeva. Massiivse nakkuse korral pea ja näo suurte haavade kaudu võib see lüheneda 12 päevani. Harvadel juhtudel võib inkubatsiooniperiood kesta ühe aasta või kauem.
Haiguse kolme perioodi vahel on rangelt järjestikune muutus: prodromaalne periood, erutus, halvatus.
Prodromaalne periood algab hammustuskohas valutava või tõmbava valu ilmnemisega, samuti närvide piirkonnas. Armi piirkonnas võib esineda põletustunne, sügelus, mõnikord punetus ja turse. Patsiendil esineb üldine halb enesetunne, peavalu, iiveldus. Märgitakse oksendamist, kehatemperatuuri tõusu 37,5–38 °C-ni ja progresseeruva vaimuhaiguse sümptomeid: suurenenud reflekserutuvus, seletamatu ärevuse, hirmu ja melanhoolia tunne. Sageli on patsient depressioonis, pidurdatud, endasse tõmbunud, keeldub söömast, magab halvasti, kurdab süngete mõtete ja hirmutavate unenägude üle. Prodromaalne periood kestab 2–3 päeva, mõnikord ulatub see 7 päevani. Selle perioodi lõpus võivad esineda ärevushood koos lühiajaliste hingamisraskustega, pigistustundega rinnus, millega kaasneb tahhükardia ja hingamissageduse tõus.
Erutusperioodi iseloomustab hüdrofoobia teke: juua püüdes ja seejärel vett nähes või selle meeldetuletusel kogeb patsient neelu ja kõri kramplikku spasmi, mille käigus viskab ta karjudes veekruusi minema, viskab värisevad käed ette, viskab pea ja keha tahapoole. Kael on välja sirutatud, nägu moonutab valulik grimass ja hingamislihaste spasmi tõttu muutub see sinakaks. Silmad on punnis, väljendavad hirmu, anuvad abi, pupillid on laienenud, sissehingamine on raskendatud. Hoo haripunktis on võimalik südame- ja hingamisseiskus. Hoo kestus on mitu sekundit, mille järel patsiendi seisund näib paranevat. Seejärel võivad kõri ja neelu lihaste spasmid tekkida isegi õhu liikumisest (aerofoobia), eredast valgusest (fotofoobia) või valjust sõnast (akustikofoobia). Hoogudega kaasneb psühhomotoorne agitatsioon, mille ajal patsient käitub nagu "hull". Teadvus on rünnaku ajal hägune, kuid selgineb interiktaalsel perioodil. Ärevuse perioodil, sümpaatilise närvisüsteemi suurenenud toonuse tõttu, esineb patsientidel süljeerituse järsk suurenemine (sialorröa) koos võimetusega sülge neelata neelulihaste spasmi tõttu. Patsient pritsib sülge. Mõnedel patsientidel võivad tekkida meningismi ja isegi opistotoonuse tunnused ning krambid on sagedased. Sellisel juhul ei pruugi tserebrospinaalvedelik muutuda, kuid mõnedel patsientidel võib valgu kontsentratsioon suureneda ja lümfotsüütide tõttu suureneda rakkude arv.
Ilma piisava ravita süvenevad dehüdratsiooni tunnused, näojooned muutuvad teravamaks ja kehakaal väheneb. Kehatemperatuur tõuseb kõrgele. Võimalikud on krambid. Erutusstaadium kestab umbes 2-3 päeva, harva 4-5 päeva. Surmaga lõppev tulemus saabub tavaliselt ühe hoo ajal. Harva elab patsient haiguse kolmanda staadiumini.
Halvatuse perioodil patsient rahuneb. Hüdrofoobia hood lakkavad, patsient saab juua ja toitu neelata, teadvus on selge. Vaatamata näilisele heaolule süvenevad aga peagi letargia, apaatia, depressioon, jäsemete halvatus, vaagnahäired, kraniaalnärvide halvatus. Kehatemperatuur tõuseb 42–43 °C-ni, vererõhk langeb ja esimese päeva lõpuks saabub surm südame-veresoonkonna ja hingamiskeskuste halvatuse tõttu.
Perifeerses veres täheldatakse neutrofiilset leukotsütoosi, hemoglobiini, erütrotsüütide ja hematokriti suurenemist.
Mis teid häirib?
Vormid
Kliiniliselt eristatakse tüüpilisi ja atüüpilisi vorme. Atüüpiliste vormide hulka kuuluvad kõik juhud, kus puudub erutus ja hüdrofoobia. Atüüpiliste vormide hulka kuuluvad bulbaarne, väikeaju, meningoentsefaliitiline jne.
Diagnostika marutaud
Marutaudi diagnoosimiseks on vaja marutaudi antigeeni, antikehade, viiruse RNA või viiruse isoleerimise tuvastamist. Kuna marutaudihaige patsiendi iga üksik test võib olla negatiivne, on mõnikord vaja võtta seerumiproove marutaudi antikehade tuvastamiseks, süljeproove viiruskultuuri jaoks ja nahabiopsiat otseseks immunofluorestsentstestiks viirusantigeeni määramiseks, eriti kui marutaudi kahtlus on suur.
Üks kiiremaid meetodeid marutaudi diagnoosimiseks inimestel enne surma on marutaudi antigeeni tuvastamiseks kukla nahabiopsial otsese immunofluorestsentstesti tegemine. Otsene immunofluorestsentstest on kõige tundlikum ja spetsiifilisem meetod marutaudi antigeeni tuvastamiseks nahas ja muudes värsketes kudedes (nt ajubiopsias), kuigi haiguse alguses võivad tulemused mõnikord olla negatiivsed. Kui värske kude pole saadaval, võib fikseeritud kudede ensümaatiline seedimine suurendada immunofluorestsentstesti reaktiivsust; tundlikkus võib aga olla vastuvõetamatult madal.
Diagnoosi saab panna ka siis, kui viirus isoleeritakse süljest pärast neuroblastoomirakkude või laborinäriliste inokuleerimist; see on tavaliselt kõige efektiivsem haiguse esimese 2-3 nädala jooksul. Diagnostiline on ka marutaudiviiruse neutraliseerivate antikehade tuvastamine vaktsineerimata isikute seerumis, mida tavaliselt tehakse kiire fluorestsentsfookuse inhibitsiooni testi (RFFIT) abil. Antikehade olemasolu tserebrospinaalvedelikus kinnitab diagnoosi, kuid need võivad ilmneda 2-3 päeva hiljem kui seerumi antikehad ja seetõttu võivad need olla haiguse algstaadiumis vähem kasulikud. Kuigi vaktsineerimisele järgnev seroloogiline vastus on üldiselt eristamatu haiguse poolt esile kutsutud seroloogilisest vastusest, ei tekita vaktsineerimine tavaliselt tserebrospinaalvedeliku antikehi.
Viimase 25 aasta jooksul on hästi dokumenteeritud vaid seitse marutaudi "tervenemise" juhtumit. Kuigi marutaudiviirust ei eraldatud üheltki patsiendilt, toetasid diagnoosi tugevalt marutaudi neutraliseerivate antikehade kõrge tiiter seerumiproovides ja neutraliseerivate antikehade olemasolu tserebrospinaalvedelikus.
Mida tuleb uurida?
Millised testid on vajalikud?
Diferentseeritud diagnoos
Inimeste marutaudi diagnoos pannakse tavaliselt epidemioloogiliste ja kliiniliste andmete põhjal ning kinnitatakse laboris. Diagnoos on lihtne, kui on esinenud loomahammustusi ja esinenud on kõik sümptomid ja tunnused. Vastasel juhul on enne spetsiifiliste laboratoorsete testide tegemist vaja hoolikat, kuid kiiret vähem tüüpiliste juhtude epidemioloogiliste ja kliiniliste tunnuste hindamist. Iga patsienti, kellel esinevad neuroloogilised tunnused või sümptomid või seletamatu entsefaliit, tuleks küsida võimaliku kokkupuute kohta loomadega marutaudi endeemilistes piirkondades elukohariigis või väljaspool seda. Marutaudi kahtluse puudumine mitme hiljutise inimese surmajuhtumi puhul Ameerika Ühendriikides võis olla tingitud kokkupuute hoolika anamneesi puudumisest.
Haiguse alguses võib marutaud jäljendada paljusid nakkushaigusi ja mittenakkushaigusi. Paljud teised entsefaliidid, näiteks herpesviiruste ja arboviiruste põhjustatud haigused, meenutavad marutaudi. Ka teised nakkushaigused võivad marutaudi jäljendada, näiteks teetanus, ajumalaaria, riketsioos ja tüüfus. Paralüütilised nakkushaigused, mida võib marutaudiga segi ajada, on poliomüeliit, botulism ja ahvi B-entsefaliit.
Mittenakkuslike haiguste hulka, mida võib marutaudiga segi ajada, kuuluvad mitmed neuroloogilised sündroomid, eriti äge põletikuline polüneuropaatia (Guillain-Barré sündroom), samuti allergiline vaktsineerimisjärgne entsefalomüeliit, mis on sekundaarne närvikoe marutaudivastase vaktsineerimise, mürgistuse või ravimimürgistuse, alkoholi võõrutusnähtude, ägeda porfüüria ja marutaudihüsteeria tagajärjel. Guillain-Barré sündroomi võib segi ajada paralüütilise marutaudiga ja vastupidi.
Kellega ühendust võtta?
Ravi marutaud
Marutaudi ravi pole välja töötatud. Spetsiifilise marutaudivastase immunoglobuliini ja leukotsüütide interferooni suurte annuste manustamine on ebaefektiivne. Patsiendi kannatuste leevendamiseks rakendatakse sümptomaatilist ravi. Sel eesmärgil paigutatakse patsient eraldi palatisse või boksi, luuakse kaitserežiim, mis piirab väliskeskkonna mõju (vähendatud müra, ere valgus, õhuvool). Kesknärvisüsteemi erutuvuse vähendamiseks määratakse unerohud, krambivastased ja valuvaigistid. Vee tasakaal normaliseeritakse.
Paralüütilises staadiumis määratakse ravimid, mis stimuleerivad südame-veresoonkonna ja hingamissüsteemi aktiivsust. Soovitatav on kasutada hüperbaarilist hapnikuga varustamist, aju hüpotermiat, kontrollitud mehaanilist hingamist koos patsiendi täieliku kurariseerimisega. Kuid kõik ravimeetodid on praktiliselt ebaefektiivsed. Parimal juhul on võimalik patsiendi eluiga pikendada mitu kuud. Ebasoodsa tulemuse määrab ajutüve kahjustuse raskusaste koos elutähtsate keskuste hävimisega.
Ärahoidmine
Pasteuri poolt 1885. aastal välja töötatud esimene marutaudivastane vaktsiin pani aluse palju tõhusamale marutauditõrjele. Tänapäeval, hoolimata inimeste peaaegu 100% suremuse määrast marutaudi tõttu, on haigus täielikult ennetatav vaktsineerimise abil enne ja/või pärast kokkupuudet. Kuigi Pasteur ja tema kolleegid algatasid erakoerte vaktsineerimise Pariisis, viidi esimene koerte massiline vaktsineerimine läbi 1920. aastate alguses Jaapanis, mis tähistas esimest suurt riiklikku marutauditõrje programmi. Metsloomade suukaudne vaktsineerimine, mis töötati esmakordselt välja 1970. aastatel, on sellest ajast alates korduvalt näidanud, et see tõrjub haigust tõhusalt peamistel maismaaperemeestel, nagu rebased, kährikud ja skunksid.[ 68 ] Reservuaarloomade populatsioonide pidev marutaudivastane vaktsineerimine 70% või kõrgema katvusega kõrvaldab lõpuks RABV reservuaarliikidelt ja takistab viiruse levikut juhuslikele peremeestele.[ 69 ]
Fülogeneetilised andmed näitavad, et lüssaviirused nakatasid nahkhiiri ammu enne maismaaimetajate nakatumist ning enamik lüssaviiruseid, sealhulgas RABV, levivad endiselt erinevates nahkhiireliikides kogu maailmas.[ 70 ] Siiski on tõhusad meetodid RABV leviku tõkestamiseks nahkhiirte vahel endiselt raskesti leitavad, mis välistab marutaudi täieliku likvideerimise võimaluse praegusel ajal. Isegi pärast kokkupuudet RABV-ga marutaudiga nakatunud imetaja hammustuse kaudu võib ohutu ja tõhus kokkupuutejärgne profülaktika (PEP, sealhulgas haavade puhastamine, marutaudi immunoglobuliin ja marutaudivastane vaktsineerimine) kaitsta inimesi marutaudi eest, kui ravi manustatakse kiiresti ja vastavalt Maailma Terviseorganisatsiooni (WHO) soovitustele.
Need kaks inimeste surmajuhtumite ennetamise meetodit – üks põhineb nakatunud inimeste vaktsineerimisel ja teine piisava arvu koerte vaktsineerimisel, et katkestada nakkustsükkel allikal – on koerte marutaudi ennetamise ja tõrje „ühe tervise” lähenemisviisi alustalad. Neid kahte erinevat inimeste surmajuhtumite ennetamise viisi kaaluti eraldi alternatiividena: strateegia A, mis põhineb inimestele PEP pakkumisel, ja strateegia B, mis põhineb koerte vaktsineerimisel; või kombineeritud strateegia A + B komponentidena alternatiivsete strateegiate tõenäoliste kulude analüüsis.[ 71 ]
Sellised riigid nagu Tai on olnud PEP-i abil inimeste surmajuhtumite ennetamisel tohutu eduga, kuid on täheldanud ka kasvavat nõudlust ja sellega seotud kulusid, mis on seotud ainult PEP-i kasutamisega. [ 72 ] Näiteks võrreldes 1991. aasta olukorraga vajas 2003. aastal PEP-i neli korda rohkem inimesi (üle 400 000). Hiljutised andmed näitavad, et Hiina Rahvavabariik, mis vaktsineerib igal aastal 15 miljonit inimest pärast võimalikku kokkupuudet marutaudiga, kulutab ainuüksi PEP-ile umbes 650 miljonit USA dollarit aastas. [ 73 ]
Palju jätkusuutlikum lähenemisviis on ennetada nakkuse levikut selle algallikal, st loomapopulatsioonis, suurendades samal ajal vajadusel juurdepääsu PEP-ile nakatunud inimestele. Kui on olemas poliitiline tahe ja piisav rahastamine koerte marutaudi tõrjeks, saab surmajuhtumeid ära hoida ja on ka ära hoitud. Koerte vaktsineerimise laialdane kasutamine on viinud koerte marutaudi likvideerimiseni mitmes riigis, sealhulgas Malaisias 1954. aastal [ 74 ], Jaapanis 1956. aastal, Taiwanis 1961. aastal, Singapuris ja eriti kogu Lääne-Euroopas (ülevaade Rupprecht jt, King jt ning Gongal ja Wright). [ 75 ]
Использованная литература


 [
[