Artikli meditsiiniline ekspert
Uued väljaanded
Ravimid
Tromboosi ennetavad ja vere reoloogiat parandavad ravimid
Viimati vaadatud: 07.07.2025

Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
Mitme mikrotrombi moodustumise ja nende hävimise ennetamiseks šoki ajal võib kasutada mitmesuguseid farmakoloogilisi lähenemisviise, mis kasutavad ravimeid, mis takistavad trombi teket ja parandavad vere reoloogiat:
- süsteemsete hemodünaamiliste ja mikrotsirkulatsioonihäirete kõrvaldamine vasoaktiivsete ja inotroopsete ainete abil;
- meetmed vere reoloogia parandamiseks ratsionaalse infusioonravi ja erütrotsüütide membraanide elastsust taastavate ravimite (trental või pentoksüfülliin) abil;
- trombotsüütide agregatsiooni ja esialgsete "valgete" trombide moodustumise ennetamine väikestes arteriaalsetes veresoontes koos järgneva koagulatsioonikaskaadi algatamisega;
- trombi moodustumise pärssimine pärast süsteemse koagulatsioonikaskaadi aktiveerimist;
- fibrinolüüsi aktiveerimine eesmärgiga lahustada äsja moodustunud verehüübed (fibrinolüsiin, streptokinaas, streptodekaas, urokinaas jne) või vastupidi, fibrinolüüsi pärssimine, kui see on üldistatud mõnedel traumaatilise šoki ja sepsisega patsientidel (aminokaproonhape, amben, kontrakal jne).
Enamik loetletud lähenemisviise on traditsioonilised, šoki ravimise praktikas hästi välja töötatud, neil on oma hemorheoloogilised näidustused ja need on täpsustatud vastavates peatükkides. Seetõttu on selles osas soovitatav keskenduda üldisele lähenemisviisile trombi tekke ennetamiseks šoki korral, kasutades farmakoloogilisi aineid, mis mõjutavad vere hüübimise profaasi. Just see hüübimiskomplikatsioonide ennetamise tase - "valgete arteriaalsete trombide" teke, moodustumine ja kasv - köidab teadlaste suurimat tähelepanu.
Erinevat tüüpi šokile on iseloomulikud mitmesugused ja sageli mitmesuunalised vere hüübimishäired koos reoloogia halvenemisega. Septilise, endotoksiini, põletuse, traumaatilise ja hemorraagilise šoki kõige iseloomulikumaks tunnuseks on mitmete mikrotrombide teke kõige väiksemates veresoontes, mis on põhjustatud süsteemse hemodünaamika häiretest, vasospasmist ja mikrotsirkulatsiooni häiretest, vere paksenemisest, sette moodustumisest, erütrotsüütide membraanide elastsuse vähenemisest, samuti arvukatest üldistest ja lokaalsetest teguritest (autokoidid), mis algatavad lokaalseid muutusi hüübimishemostaasis ja vere hüübimise profaasi kaasamises.
Skemaatiliselt (lühendatud) kujul on hemokoagulatsiooni algstaadium ja lokaalse hemokoagulatsiooni homöostaasi mehhanism esitatud järgmiselt.
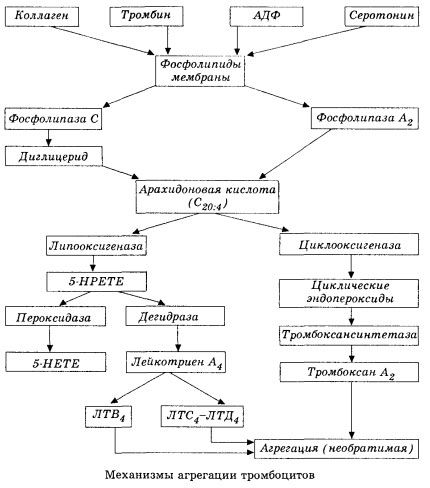
See algab membraanfosfolipaas A2 aktiveerumisega kahjustavate tegurite (otsene membraanikahjustus, hüpoksia, lipiidide peroksüdatsioon, endogeensete keemiliste tegurite mõju jne) kombinatsiooni tagajärjel. Membraanfosfolipiidide lagunemise tulemusena vabanevad esterdamata pika ahelaga rasvhapped, millest arahhidoonhape on esmase substraadina kõige olulisem. Selle transformatsioon (arahhidoonhappe kaskaad) toimub lipoksügenaasi (leukotrieenide süntees) ja tsüklooksügenaasi (prostaglandiinide, tromboksaanide, prostatsükliini süntees) radade kaudu.
Tekkivad leukotrieenid (B4, C4, E4, D4 jne) - äärmiselt kõrge bioloogilise aktiivsusega ained, mille hulka kuulub aeglaselt reageeriv anafülaksia aine - on väga olulised lokaalsete vaskulaarsete, põletikuliste ja immuunreaktsioonide, sealhulgas autoimmuunprotsesside algatamisel. Leukotrieenid põhjustavad mikrotsirkulatsiooni häireid, suurenenud vere hüübimist, autolüütiliste lüsosomaalsete ensüümide vabanemist ning müokardi kontraktiilsust ja bronhide spasmi pärssiva faktori vabanemist verre.
Tänu oma võimele põhjustada silelihaste kokkutõmbumist mõjutavad leukotrieenid oluliselt süsteemset hemodünaamikat, koronaarveresooni ja müokardi, avaldades võimsat koronaarahendajat ja negatiivset inotroopset efekti, millega kaasneb südame väljundmahu vähenemine ja mis mängib olulist rolli hüpotensiooni tekkes.
Südame minutimahu vähenemine ja hüpotensiivne reaktsioon leukotrieenidele on seotud südamelihase nõrgenemise ja venoosse tagasivoolu piiramisega südamesse. Venoosse tagasivoolu piiramisel on olulise tähtsusega leukotrieenide võime suurendada veresoone seina läbilaskvust ja põhjustada plasma ekstravasatsiooni. Leukotrieene peetakse oluliseks müokardiinfarkti patogeneesis.
Anafülaktilise ja septilise (endotoksiini) šoki korral suureneb nende roll ilmselt veelgi, mida tõendab leukotrieenide võime allergiliste reaktsioonide ajal plasmas märkimisväärses koguses akumuleeruda ja põhjustada anafülaktilisele šokile iseloomulikke süsteemse verevoolu muutusi, samuti leukotrieeni retseptori blokaatorite ja lipoksügenaasi inhibiitorite kaitsev toime. Selektiivsete leukotrieeni retseptori blokaatorite väljatöötamine toimub üsna intensiivselt ja see on paljutõotav teadussuund. Selles valdkonnas on juba saavutatud teatavat edu ja selliste blokaatorite efektiivsust müokardi isheemia, endotoksiini ja hemorraagilise šoki korral on eksperimentaalselt kinnitatud. Selle suuna kliiniliseks rakendamiseks kulub aga tõenäoliselt veel mitu aastat.
Kui venoossetes veresoontes moodustuvad trombid trombotsüütide ja plasma hüübimisfaktorite võrdse osalusel, siis arterites on protsessi peamisteks initsiaatoriteks trombotsüüdid. Need sisaldavad ADP-d, Ca2+, serotoniini, fosfolipiide, prostaglandiini ja tromboksaani sünteesi ensüüme, trombosteniini (sarnaselt lihaste aktomüosiiniga tagab see nende rakkude kontraktiilse võime), epiteeli ja veresoone seina lihasrakkude trombogeenset kasvufaktorit ja mitmeid teisi aineid. Trombotsüütide funktsioonide humoraalne regulatsioon toimub nende membraanide spetsiifiliste retseptorite kaudu (alfa2- ja beeta2-adrenoretseptorid, histamiini ja serotoniini retseptorid, atsetüülkoliin, tromboksaan, adenosiin ja mitmed teised). Trombotsüütide eriliseks omaduseks on kõrge afiinsus kollageeni ja teiste veresoone seina subendoteliaalsete elementide, mittemärgavate ja negatiivselt laetud pindade suhtes. See omadus annab trombotsüütidele erakordse võime kleepuda kahjustatud endoteeliga veresoone sektsioonile, millel on suur võimalus šoki ajal kahjustuda. Sellisel juhul trombotsüüdid levivad laiali ja vabastavad pseudopoode, mis saavad kleepuda üksteise ja veresoone seina külge. Membraani läbilaskvus suureneb ning trombotsüütide pinnale adsorbeerunud ADP, serotoniin, tromboksaan ja mõned hüübimisfaktorid vabanevad trombotsüütidest. Need ained interakteeruvad membraanil olevate vastavate retseptoritega ja kaltsiumiioonide osalusel põhjustavad agregatsiooni (esialgu pöörduvat). Protsess muutub isemajandavaks, mida soodustavad humoraalsed regulatiivsed faktorid; teised tegurid võivad seda vastupidi peatada ja isegi tagasi pöörata, põhjustades lagunemist.
Trombi moodustavate mõjude ja tingimuste ülekaalu korral asenduvad adhesiooni- ja pöörduva agregatsiooni faasid kolmanda faasiga - pöördumatu agregatsiooniga, mis viiakse läbi trombosteniini osalusel ja viib trombi ahenemiseni; agregandi tugevnemise ja ahenemise reaktsioon toimub samuti Ca+ ja ATP osalusel ning viib valge trombi moodustumiseni.
Arahhidoonhappe muundamise tsüklooksügenaasi rada trombotsüütides, veresoonte endoteelirakkudes ja teistes kudedes tagab lokaalse (metaboliitide poolväärtusaeg on väga lühike) koagulatsioonihomeostaasi, kuna selle metabolismi käigus tekivad võimsad pro- ja antiagregandid. Tsüklooksügenaasi reaktsiooniahelas on trombotsüütide agregatsiooni peamine aktiveeriv tegur tromboksaan A2 ja selle mitte vähem võimas antagonist on endoteelirakkude poolt toodetav prostatsükliin ning vähemal määral E- ja G-seeria prostaglandiinid. Lõpuks mõjutavad trombotsüütide agregatsiooni tugevalt täiendavad lokaalsed ja süsteemsed humoraalsed tegurid.
Trombotsüütide agregatsiooni aktivaatorid ja inhibiitorid
Trombotsüütide agregatsiooni initsiaatorid ja aktivaatorid |
Trombotsüütide agregatsiooni inhibiitorid |
Kollageen |
- |
ADP |
Adenosiin ja selle stabilisaatorid |
Norepinefriin (alfa2 retseptorite kaudu) |
Alfa-adrenergilised blokaatorid |
Serotoniin |
Antiserotoniini ained |
Histamiin |
Antihistamiinikumid |
Trombiin |
Hepariin |
Ca2+ |
Ca2+ antagonistid |
CGMP - selle indutseerijad (atsetüülkoliin?) ja stabilisaatorid |
CAM - selle indutseerijad (beeta-adrenergiliste retseptorite kaudu) ja stabilisaatorid (fosfodiesteraasi inhibiitorid) |
Arahhidoonhape |
Dekstraanid, albumiin |
Tromboksaan A2 |
Prostatsükliin I2 |
Farmakoloogilised sekkumised trombi moodustumise algfaasis šoki ja ägedate isheemiliste protsesside korral südames ja ajus viitavad järgmisele võimalusele:
- arahhidoonhappe kaskaadi esialgsete reaktsioonide (täielike ja osaliste) pärssimine;
- tromboksaani sünteesi teatud reaktsiooni pärssimine;
- leukotrieenide ja tromboksaanide retseptorite blokeerimine trombotsüütides, silelihastes ja teistes rakkudes;
- trombotsüütide agregatsiooni moduleerivate ainete kasutamine, st nõrgestavad muul viisil viimase reaktsiooni initsieerivate tegurite (kollageen, tromboksaan A2, leukotrieenid jne) mõjule.
Loetletud vere reoloogiliste omaduste häirete korrigeerimise meetodite rakendamine tagab peamise taktikalise ülesande lahendamise: kaitsta trombotsüütide agregatsiooni ja adhesiooni retseptoreid aktivaatorite mõju eest või pärssida nende retseptorite rakusiseseid sünteesimehhanisme. Arahhidoonhappe kaskaadi esialgsete reaktsioonide pärssimist saab saavutada polümeersete aktivaatoritega reageerivate trombotsüütide retseptorite kaitsmisega madalmolekulaarsete dekstraanide abil, mille molekulid konkureerivad fibriini, kollageeni, agregeeritud immunoglobuliini (IgE) ja komplemendisüsteemi komponentidega.
Maskeerides trombotsüütide membraanil olevaid retseptoreid ja konkureerides erütrotsüütide pinnal olevate suures koguses hajutatud valkudega, tõrjuvad madalmolekulaarsed dekstraanid need välja ja hävitavad rakkudevahelised sillad. See on tingitud asjaolust, et dekstraanid, mis katavad veresoonte endoteeli ja vererakkude pinda, suurendavad nende negatiivset laengut, tugevdades seeläbi antiagregatsiooniomadusi.
Dekstrans
Madala molekulmassiga dekstraanid vähendavad kollageeni ja ADP poolt indutseeritud trombotsüütide agregatsiooni, samuti trombiini aktiveerivat toimet trombotsüütidele, pärsivad esialgse valgeliblede trombi kasvu, parandavad verevoolu, vähendavad plasma fibrinogeenisisalduse postoperatiivset suurenemist ning muudavad fibriini struktuuri ja stabiilsust.
Dekstraanide intravenoosne infusioon trauma ja šoki korral mitte ainult ei vähenda trombotsüütide agregatsiooni ja adhesiooni, vaid mobiliseerib ka endogeenset hepariini, soodustades seeläbi lahtise ja raskesti tagasitõmbuva verehüübe teket, mida fibrinolüütikumid kergesti lüüsivad. Madala molekulmassiga dekstraanide antitrombiini aktiivsus on seotud nende spetsiifilise mõjuga vere hüübimisfaktori VIII struktuurile ja funktsioonile. Faktor VIII (antihemofiilne globuliin), suur molekul, millel on keeruline struktuur ja funktsioon, osaleb trombotsüütide agregatsioonis ja tekkiva trombi stabiilsuses. Dekstraanid häirivad VIII faktori toimet, aeglustades seeläbi trombotsüütide agregatsiooni ja vähendades trombi stabiilsust.
Madala molekulmassiga dekstraanid ei ole tõelised antikoagulandid ja nende korrigeeriv toime hemorheoloogiliste häirete korral on seotud peamiselt hemodilutsiooni, ringleva plasma mahu täiendamise ja verevoolu paranemisega mikrotsirkulatsioonisüsteemis.
Dekstraanide võime parandada verevoolu hemodünaamiliste häirete (šokk, verekaotus) korral on tingitud mitmete tegurite kompleksist. Polümeeri kõrge mööduva kontsentratsiooni esinemine veres mitte ainult ei põhjusta "otsest hemodilutsiooni", vaid loob ka tingimused vedeliku voolamiseks vereringesse interstitsiaalsest ruumist ja sellele järgnevaks dekstraani osmootse toime tasakaalustamiseks. Hemodilutsiooni tagajärjel väheneb vere viskoossus, suureneb venoosne sissevool südamesse ja südame väljundmaht. Lisaks nendele toimetele moodustavad dekstraanid fibrinogeeniga komplekse ja omavad lipiidivastast toimet.
Seega aitavad madalmolekulaarsete dekstraanide agregatsioonivastane toime ja hemodünaamilised efektid vähendada vere viskoossust, mis on eriti oluline madalate nihkekiiruste korral. Vererakkude desagregatsioon parandab süsteemset verevoolu ja mikrotsirkulatsiooni, eriti selle venoosses osas, kus kiirusegradiendid on kõige madalamad. Madalmolekulaarsete dekstraanide lahuste kasutamine erinevat tüüpi šoki korral, vigastuste ja nende tagajärgede kirurgilise ravi ajal ning seejärel operatsioonijärgsel perioodil aitab vältida hüperkoagulatsiooni ja vähendada trombootiliste protsesside ja emboolia tõenäosust.
Siiski tuleb märkida, et mõnel juhul kaasnevad dekstraanilahuste infusiooniga anafülaktilised ja allergilised reaktsioonid (ohtlikud sensibiliseerimise ja anafülaktilise šoki korral). See on tingitud asjaolust, et suure molekulmassiga ja paljude külgahelatega dekstraanid võivad toimida antigeenina. Seetõttu on individuaalse tundlikkuse kindlakstegemiseks soovitatav enne anesteesia sisseviimist manustada intravenoosselt kuni 20 ml madalmolekulaarset dekstraanilahust hapteenina (15% lahus, molekulmass 1000) ja teha plasmaasendaja infusioone.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
Trombiini inhibiitorid
Trombotsüütide aktivaatoritega interakteeruvate trombotsüütide retseptorite farmakoloogilist kaitset saab saavutada ka ainete abil, mis konkureerivad mittepolümeersete trombotsüütide aktivaatoritega või inhibeerivad neid. Selliste ainete hulka kuuluvad trombiini inhibiitorid (hepariin ja hirudiin, mitmed sünteetilised inhibiitorid, adrenaliini antagonistid), alfa-retseptorite blokaatorid (fentolamiin, dihüdroergotamiin), ADP antagonistid (dipüridamool, adenosiin ja selle struktuurianaloogid, fosfokreatiin), serotoniini antagonistid (metüsergiid). Ainult mõnda loetletud ainet kasutatakse tegelikult erineva päritoluga šoki ennetamiseks ja raviks.
Trombotsüütide agregatsiooni ja adhesiooni aktivaatoritega reageerivate valguretseptorite rakusiseste sünteesimehhanismide kaitsmine ja tromboksaani sünteesiprotsesside pärssimine on võimalik erinevate rühmade ravimitega:
- cATP, prostatsükliini ja prostaglandiin PgE2 indutseerijad ja stabilisaatorid;
- fosfolipaasi ja fosfodiesteraasi inhibiitorid.
Spetsiaalsete trombotsüütidevastaste ainete intensiivne väljatöötamine algas suhteliselt hiljuti ja pole veel usaldusväärsete tulemusteni viinud. Praegu kasutatakse kliinilises praktikas lisaks dekstraanilahustele laialdaselt selliseid trombotsüütidevastaseid aineid nagu atsetüülsalitsüülhape, indometatsiin, dipüradamool, sulfiinpürasoon (persantin), prostatsükliin (eikoprostenoon) ja hepariin, et vältida valgete trombotsüütide trombide teket.
Mittesteroidsed põletikuvastased ravimid
On kindlaks tehtud, et mittesteroidsete põletikuvastaste ravimite - atsetüülsalitsüülhappe ja indometatsiini - farmakoloogiline toime tuleneb nende mõjust eikosanoidide (tromboksaanide ja prostaglandiinide) metabolismile. Peaaegu kõik selle rühma ravimid pärsivad prostaglandiini süntetaasi nime all tuntud ensüümikompleksi, avaldades seeläbi oma spetsiifilist ja trombotsüütidevastast toimet.
Atsetüülsalitsüülhape imendub pärast suukaudset manustamist väga kiiresti. Selle hüdrolüüsi produkt, salitsüülhape, pärsib trombotsüütide tsüklooksügenaasi, mis omakorda häirib arahhidoonhappe muundumist prostaglandiin O2-ks ja lõpuks tromboksaan A2-ks. Atsetüülsalitsüülhape pärsib kollageeni, ADP, adrenaliini ja serotoniini poolt indutseeritud agregatsiooni. Kuigi selle GG0 5 on 15 minutit, kestab antiagregantne toime mitu päeva, mis on ilmselt seletatav prostaglandiini sünteesi reaktsioonide pöördumatu pärssimisega ja trombotsüütide agregatsiooni funktsiooni pärssimisega kogu nende eluea jooksul (6-10 päeva). Lisaks trombotsüütide tsüklooksügenaasi pärssimisele pärsib atsetüülsalitsüülhape suurtes annustes veresoone seina tsüklooksügenaasi ja samaaegselt tromboksaan A2 sünteesi pärssimisega pärsib prostatsükliini sünteesi endoteelirakkudes. Seetõttu tuleks atsetüülsalitsüülhapet antiagregandina välja kirjutada väikestes annustes (3000-5000 mg/päevas), mis pärsivad peamiselt trombotsüütide agregatsiooni.
Arvestades, et atsetüülsalitsüülhape blokeerib trombotsüütide tsüklooksügenaasi mitu päeva ja endoteeli tsüklooksügenaasi mitte rohkem kui ühe päeva, on otstarbekas ravimit välja kirjutada mitte iga päev, vaid iga 3-4 päeva tagant. Atsetüülsalitsüülhappe optimaalse annuse valimine patsiendile tuleks läbi viia individuaalselt, kuna patsientide tundlikkus ravimi trombotsüütidevastase toime suhtes on erinev. Reaktiivsetel patsientidel pärsib atsetüülsalitsüülhape annuses 0,5 g trombotsüütide agregatsiooni 40-50%, hüperaktiivsetel patsientidel täielikult või 80-90% ja refleksiivsetel patsientidel on sama ravimiannuse võtmisel trombotsüütidevastase toime puudumine iseloomulik.
Selektiivsed tromboksaani süntetaasi inhibiitorid on imidasool ja selle analoogid, mis ei blokeeri tsüklooksügenaasi. Dipüridamool, mida kliinilises praktikas kasutatakse kroonilise isheemilise südamehaiguse ravis koronaararterite laiendajana, pärsib sarnaselt imidasoolile selektiivselt tromboksaani süntetaasi, takistades tromboksaan A2 sünteesi. Arvatakse, et ravim ja selle analoogid pärsivad ka trombotsüütide fosfodiesteraasi, suurendades seeläbi cAMP kontsentratsiooni trombotsüütides. Lisaks sellele pärsib dipüridamool adenosiindeaminaasi aktiivsust ja adenosiini omastamist trombotsüütide poolt, blokeerib serotoniini imendumist trombotsüütide poolt ja nende agregatsiooni, mida indutseerivad adrenaliin ja kollageen. On teateid ravimi nõrgast trombotsüütidevastasest aktiivsusest ja selle võimest väikestes annustes suurendada trombotsüütide agregatsiooni. Kõige usaldusväärsemat trombotsüütidevastast toimet saab saavutada dipüridamooli ja atsetüülsalitsüülhappe kombinatsiooniga.
Hepariin
Tromboosivastaste ainete seas on hepariin üks efektiivsemaid vere agregaatseisundi regulaatoreid, eriti varajasel kasutamisel. Hepariinil on kõrge negatiivne laeng ja see on võimeline suhtlema nii suurte kui ka väikeste ioonide ja molekulidega (ensüümid, hormoonid, biogeensed amiinid, plasmavalgud jne), seega on selle bioloogilise toime spekter üsna lai. Ravimil on antitrombiini, antitromboplastiini ja antiprotrombiini toime, see takistab fibrinogeeni muundumist fibriiniks, pärsib trombi tagasitõmbumist ja suurendab fibrinolüüsi.
Hepariini antikoagulantse toime mehhanism on üsna keeruline. Nüüdseks on kindlaks tehtud, et hepariini antikoagulantne toime on seotud antitrombiin III toime võimendumisega ja hepariin-antitrombiin III kompleksi võime suurenemisega inaktiveerida kiiresti enamikku vere hüübimissüsteemi seriinproteaase. Hepariini antitrombootilises toimes on suur tähtsus selle võimel suurendada ja säilitada veresoonte intima kõrget elektronegatiivset potentsiaali, takistades trombotsüütide adhesiooni ja trombotsüütide mikrotrombide moodustumist. Hepariin pärsib kõige aktiivsemalt trombide teket veenides, ennetades nii lokaalset trombide teket kui ka dissemineerunud intravaskulaarset koagulatsiooni.
Prostatsükliin ja selle stabiilsed analoogid
Trombotsüütidevastaste ainete seas on kõige võimsamad agregatsiooni inhibiitorid prostatsükliin ja selle stabiilsed analoogid. Prostatsükliini trombotsüütidevastane toime tuleneb adenülaattsüklaasi stimuleerimisest ja selle tagajärjel cAMP kontsentratsiooni suurenemisest trombotsüütides, tromboksaani sisalduse vähenemisest, tromboksaan A2 sisalduse vähenemisest ja selle retseptorite blokeerimisest. Prostatsükliin on ebastabiilne ja hüdrolüüsub kiiresti inaktiivseteks produktideks, seetõttu manustatakse seda intravenoosselt tilguti kiirusega 2 kuni 20 ng/kg minutis 30-60 minuti jooksul kuni 6 korda päevas.
Lisaks tugevale antiagregatiivsele toimele on prostatsükliinil võimas vasodilataator ja bronhodilataator. Ravim laiendab aju, südame, neerude, skeletilihaste ja mesenteeriliste veresoonte sooni. Prostatsükliini mõjul suureneb koronaarverevool, suureneb müokardi energiavarustus ja väheneb selle hapnikuvajadus. Vaatamata selle ebastabiilsusele organismis võivad kliiniliselt soodsad toimed kesta mitu nädalat ja isegi kuud. Sellise pikaajalise toime mehhanism pole veel selge.
Prostatsükliin on vähetoksiline ravim, kuid selle kasutamine võib põhjustada kõrvaltoimeid: näo punetust, peavalu, vererõhu langust, kõhuvalu, isutust. Koos prostatsükliiniga on selle sünteetilised stabiilsed analoogid (iloprost jne) paljulubavad trombotsüütide agregatsiooni inhibiitorid.
Ravimid, mis parandavad vere viskoossust
Vere reoloogiliste omaduste häired trauma ja šoki ajal ei ole põhjustatud ainult trombotsüütide funktsionaalse aktiivsuse muutustest, vaid ka vere viskoossuse suurenemisest. Vere kui keerulise dünaamilise hajussüsteemi struktuurne viskoossus on suuresti määratud plasma viskoossuse ja erütrotsüütide deformeerumisvõime poolt. Plasma viskoossus sõltub peamiselt veres leiduvate valkude kontsentratsioonist. Väikese molekulmassiga valgud, näiteks albumiin, mõjutavad plasma viskoossust vähe, samas kui suure molekulmassiga valgud (fibrinogeen, alfa- ja gamma-globuliinid, teised makromolekulid) suurendavad seda oluliselt.
Madalate nihkekiiruste korral viib fibrinogeeni ja globuliinide adsorptsioon erütrotsüütide pinnale sildade moodustumiseni külgnevate rakkude vahel ja erütrotsüütidest agregaatide moodustumiseni. Agregaatide moodustumise kiirus on keeruline biofüüsikaline protsess ja sõltub lisaks nihke suurusele ka erütrotsüütide elektrokineetilistest omadustest, makromolekulide-agregaatorite kontsentratsioonist, massist ja sorptsioonivõimest, erütrotsüütide kujust ja plastilisusest.
Erütrotsüüdi membraani kuju ja mehaaniliste omaduste säilitamine nõuab märkimisväärset energiakulu. Arvatakse, et erütrotsüütides glükolüüsi käigus tekkiv energia kulub spektriini fosforüülimisele, mille tulemuseks on muutused valgu sekundaarstruktuuris ja interaktsioon sisemembraani naaberkomponentidega. Membraani struktuurvalkude, spektriini ja aktiini, interaktsioon mängib olulist rolli erütrotsüüdi membraani mehaaniliste omaduste kujunemisel, erütrotsüüdi pindala ja paksuse konstantse säilitamisel mis tahes deformatsiooni korral.
Süsteemsete hemodünaamiliste ja elundite verevoolu häirete korral põhjustab erütrotsüütide membraanide jäikuse suurenemine ja erütrotsüütide agregaatide moodustumine erütrotsüütide kapillaaride läbimise kiiruse vähenemist, mis omakorda häirib vere gaasitranspordi funktsiooni. Seetõttu peaks šokis oleva vere reoloogiliste omaduste häirete korrigeerimine hõlmama lisaks erütrotsüütide agregatsiooni ennetamisele ka plasma ja vere viskoossuse, erütrotsüütide agregatsiooni ja deformatsiooni normaliseerimist.
Lisaks madalmolekulaarsetele dekstraanidele on albumiini lahused üks tõhusaid vahendeid vere suspensiooni stabiilsuse suurendamiseks. Šoki hilisemas perioodis toimub erütrotsüütide generaliseerunud agregatsioon vereplasmas albumiini kontsentratsiooni vähenemise ja fibrinogeeni ja globuliinide, eriti alfa2 fraktsiooni, lipoproteiinide ja lipiidide kontsentratsiooni suurenemise taustal. Nendes tingimustes tulenevad albumiini reoloogilised toimed kahest peamisest tegurist: hemodilutsioon ja mikro- ja makroglobulaarsete valkude suhte normaliseerumine plasmas. Samal ajal seob albumiin vabu happeid, mille labiliseerumine trauma ja šoki ajal stimuleerib vere rakuliste struktuuride agregatsiooni ja intravaskulaarset koagulatsiooni ning võib põhjustada rasvaembooliat.
Ringleva vere mahu täiendamisele, kudede hüpoksia ja metaboolse atsidoosi kõrvaldamisele suunatud šokivastased meetmed aitavad kaasa erütrotsüütide membraanide elastsuse normaliseerumisele, kuna hüpoksia ja atsidoos vähendavad oluliselt erütrotsüütide deformeeritavust. Erütrotsüütide membraanide suurenenud jäikus šoki ajal on tõenäoliselt seotud ATP sünteesi pärssimisega erütrotsüütides. ATP kontsentratsiooni vähenemine omakorda aitab kaasa Ca2+ kontsentratsiooni suurenemisele erütrotsüütides, mis membraanivalkudega seondudes suurendab membraani jäikust.
Üks farmakoloogilistest ravimitest, mis suurendab erütrotsüütide ATP sisaldust ja erütrotsüütide membraanide elastsust, on Trental (pentoksüfülliin), mida kliinilises praktikas kasutatakse isheemiliste häirete raviks.
Lisaks erütrotsüütide membraanide jäikuse vähendamisele põhjustab Trental vasodilatatsiooni, parandab kudede hapnikuga varustatust, pärsib fosfodiesteraasi aktiivsust kudedes, suurendab cAMP kontsentratsiooni ja pärsib trombotsüütide agregatsiooni.
Teiste erütrotsüütide membraani elastsust säilitavate farmakoloogiliste ainete hulgas väärib märkimist Ca2+ antagonistid, mis piiravad ioonide voolu erütrotsüütidesse (flunarisiin, nifedipiin jne).
 [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Tähelepanu!
Teabe tajumise lihtsustamiseks tõlgendatakse seda juhendit ravimi "Tromboosi ennetavad ja vere reoloogiat parandavad ravimid" kasutamiseks ja esitatakse erilisel kujul ravimite meditsiinilise kasutamise ametlike juhiste alusel. Enne kasutamist lugege otse ravimile lisatud märkust.
Kirjeldus on esitatud informatiivsel eesmärgil ja see ei ole juhend enesehoolduseks. Selle ravimi vajadust, raviskeemi eesmärki, ravimeetodeid ja annust määrab ainult raviarst. Enesehooldus on teie tervisele ohtlik.

