Artikli meditsiiniline ekspert
Uued väljaanded
Hüpofüüsiline aneemia (kääbus)
Viimati vaadatud: 12.07.2025

Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
Mõiste "hüpofüüsi kääbuskasvukus" (kreeka keelest nanos - kääbus; sün.: kääbuskasvukus, nanosomia, mikrosomia) tähendab absoluutses tähenduses haigust, mille peamiseks ilminguks on järsk kasvupeetus, mis on seotud kasvuhormooni sekretsiooni rikkumisega hüpofüüsi eessagara poolt.
Laiemas tähenduses on kääbuskasv kasvu- ja füüsilise arengu häire, mille esinemist võib põhjustada mitte ainult somatotroopse hormooni absoluutne või suhteline puudulikkus, mis on tingitud hüpofüüsi enda patoloogiast, vaid ka hüpotaalamuse (aju) funktsioonide regulatsiooni häire, somatotroopse hormooni biosünteesi defektid ja kudede tundlikkuse häired selle hormooni suhtes.
Põhjused kääbus
Enamik hüpofüüsi kääbuskasvu vorme on geneetilised haigused. Kõige levinum on panhüpopituitaarne kääbuskasv, mis pärandub peamiselt retsessiivselt. Eeldatakse, et sellel patoloogiavormil on kaks edasikandumisviisi - autosomaalne ja X-kromosoomi kaudu. Selle kääbuskasvu vormi korral on koos somatotroopse hormooni sekretsiooni defektiga kõige sagedamini häiritud gonadotropiinide ja kilpnääret stimuleeriva hormooni sekretsioon. AKTH sekretsioon on häiritud harvemini ja vähemal määral. Funktsionaalsed uuringud vabastavate hormoonidega, sealhulgas sünteetilise somatotropiini vabastava hormooniga (koosneb 29, 40 ja 44 aminohappejäägist), mis sarnaneb pankrease polüpeptiidiga, on näidanud, et enamikul neist patsientidest on patoloogia hüpotalamuse tasemel ja hüpofüüsi eessagara puudulikkus on sekundaarne. Hüpofüüsi enda primaarne patoloogia on vähem levinud.
Isoleeritud kasvuhormooni puudulikkusega geneetiline kääbuskasvukus, mille bioloogiline aktiivsus ja tundlikkus selle suhtes on häiritud, esineb Venemaal ja naaberriikides juhuslikult. See on sagedasem Ameerika mandril, Lähis-Ida ja Kesk-Ida riikides ning Aafrikas. Somatotroopse hormooni veresisalduse ja patsientide eksogeense somatotroopse hormooni tundlikkuse, immunoreaktiivse insuliini (IRI), insuliinilaadsete kasvufaktorite (IGF) I tüüpi (somatomediin C) ja II tüüpi taseme ning IGF-1 ravivastuse somatotroopsete hormoonpreparaatidega uuringu tulemuste põhjal on tuvastatud kliiniliselt sarnaste kääbuskasvu tüüpide erinevad variandid.
Hiljuti on dešifreeritud Laroni kääbuskasvu patogenees, mis on põhjustatud IRF-1 ja IRF-II puudulikkusest, samuti Aafrika pügmeede kääbuskasvu patogenees, mis on seotud esimese puudulikkusega.
1984. aastal kirjeldati pseudohüpofüüsi kääbuskasvu uut varianti, millel on kõrge somatotroopse hormooni ja IGF-1 tase; kääbuskasvu teket seletatakse selle retseptorite defektiga, mida tõestab naha fibroblastide IGF-1-ga seondumise järsk vähenemine.
Tuleb rõhutada, et tänapäeva tingimustes, väikeste perede olemasolul, võivad paljud isoleeritud ("idiopaatilised", juhuslikud) haiguse juhtumid olla ka geneetilised.
350 haigusloo analüüsis jäi kääbuskasvu etioloogia ebaselgeks 228 patsiendil (65,2%). Sellesse gruppi kuulusid patsiendid 57 perekonnast, kellel esines korduvalt kääbuskasvu (2-4 juhtu perekonna kohta), mis moodustas 28% kõigist patsientidest. 77%-l peredest, kellel esines etioloogiliselt ebaselgeid (peamiselt geneetilisi) kääbuskasvu vorme, tehti kindlaks vaieldamatu seos Rh-faktori puudumise pärilikkusega. Rh-faktori jaotus kääbuskasvuga patsientide peredes erineb ema ja loote vahelise Rh-konflikti korral täheldatust ning reeglina ei kaasne sellega vastsündinu hemolüütiline haigus (isa võib olla Rh-negatiivne ja vanemate Rh-faktori heterosügootsuse korral lapsed jne). Võib eeldada seost somatotroopse hormooni (või somatotropiini vabastava hormooni) sünteesi eest vastutavate geenide aktiivsuse ja Rh-faktorit määravate geenide vahel, eriti kuna enamik kääbuskasvu vorme ja Rh-faktori puudumine on autosoom-retsessiivsed tunnused. See ei seleta kääbuskasvu suhtelist haruldust võrreldes Rh-negatiivsete indiviidide esinemissagedusega populatsioonis. Tõenäoliselt on olulised ka mõned seni teadmata lisategurid, kuid Rh-faktori jaotuse iseärasused perekondliku ja sporaadilise kääbuskasvuga patsientide perekondades ei ole tõenäoliselt juhuslikud.
Suur osa kääbuskasvuga (primaarne tserebraalne, tserebrohüpofüüsi) patsientidest on patsiendid, kellel esineb kesknärvisüsteemi erinevat tüüpi orgaanilisi patoloogiaid, mis tekkisid emakas või varases lapsepõlves. Selle patoloogia põhjustavaks anatoomiliseks substraadiks võivad olla hüpofüüsi alaareng või puudumine, selle düstoopia turjakõrva moodustumise patoloogias, hüpofüüsi tsüstiline degeneratsioon, selle atroofia kasvaja kokkusurumise tõttu (kraniofarüngioom, kromofoobne adenoom, meningioom, glioom). Kääbuskasvu võivad põhjustada hüpotaalamuse-hüpofüüsi piirkonna traumaatilised vigastused (emakasisene, sünnijärgne või sünnitusjärgne), mis esinevad sageli mitmikraseduse korral, samuti sünnituse ajal tuharseisus, jalal või põikiasendis jala pöörlemisega (see on sünnitusmehhanism enam kui 1/3 kääbuskasvuga patsientidest). Olulised on nakkuslikud ja toksilised kahjustused (emakasisene viirusnakkus, tuberkuloos, süüfilis, malaaria, toksoplasmoos; varases eas esinevad haigused, vastsündinute sepsis, meningo- ja arahnoentsefaliit jne). Need protsessid võivad kahjustada hüpofüüsi ennast, selle tööd reguleerivaid hüpotaalamuse keskusi ja häirida kesknärvisüsteemi normaalseid funktsionaalseid ühendusi.
Emakasisesed lootekahjustused võivad viia patsientide sünnini, kellel on sünnist saati kääbuslikkus ja kellel on normaalne kasvuhormooni sekretsioon (aju ürgne kääbuslikkus, mikrotsefaalia, Silver-Russelli kääbuslikkus koos keha hemiasümmeetria ja kõrge gonadotropiinide tasemega jne).
Täiendavad tegurid, mis süvendavad füüsilise arengu rikkumist kääbuskasvus, võivad olla ebapiisav toitumine, tasakaalustamata oluliste koostisosade (valgupuudus) ja mikroelementide (tsingipuudus) osas ning ebasoodsad keskkonnatingimused, samuti mitmesugused kroonilised haigused, näiteks glomerulonefriit, mille puhul asoteemia mõjutab maksa retseptorite aktiivsust või mõjutab otseselt maksarakkude ainevahetust, põhjustades somatomediini sünteesi vähenemist või maksatsirroosi, kui somatomediini moodustumine on häiritud.
Pathogenesis
Enamikul hüpofüüsi kääbuskasvuga patsientidest ei piirdu muutused somatotroopse hormooni sekretsiooni patoloogia ja selle suhtes tundlikkusega, vaid laienevad ka teistele hüpofüüsi troopilistele hormoonidele, mis põhjustab endokriinsete ja ainevahetushäirete erinevaid kombinatsioone.
Isoleeritud somatotroopse hormooni puudulikkuse korral on hüpofüüsi morfoloogilisi muutusi vähe uuritud. Uuritud juhtudel leiti patoloogilisi häireid harva (kraniofarüngioom või kolju luude hüperostoos). Seda tüüpi kääbuskasvu korral võib täheldada peptidergiliste rakkude kaasasündinud alaarengut või hüpotalamuse neurotransmitterisüsteemi defekti. Sellistel juhtudel võib kääbuskasvu kombineerida nägemisnärvide düsplaasia või hüpoplaasiaga. Intrasellaarsed tsüstid, hüpofüüsi ja hüpotalamuse kasvajad põhjustavad STH puudulikkust, põhjustades hüpofüüsi koe, eriti somatotroofide, kokkusurumist.
Kääbuskasvule on iseloomulik luude hõrenemine, mis on peamiselt tingitud kortikaalsest kihist, skeleti hilinenud diferentseerumine ja luustumine. Siseorganid on hüpoplastilised, mõnikord atroofilised ja lihased on halvasti arenenud.
Sümptomid kääbus
Hüpofüüsi kääbuskasvu peamised ilmingud on järsk kasvu ja füüsilise arengu mahajäämus. Patsiendid sünnivad normaalse kehakaalu ja pikkusega ning hakkavad kasvus maha jääma 2-4-aastaselt.
Enne nanismi aktiivse ravi tulekut peeti kääbusteks neid, kelle pikkus oli naistel alla 120 cm ja meestel alla 130 cm. Praegu erineb kääbuse pikkus antud soo, vanuse või populatsiooni puhul keskmisest tabelinormist vähemalt 2-3 sigma hälbe võrra. Samuti on olemas meetod pikkuse graafiliseks hindamiseks Gaussi jaotuskõvera põhjal. Sellisel juhul kaasatakse pikkuse järgi kääbused rühma, mis hõlmab vastavas populatsioonis minimaalset arvu isendeid, kellel on suurim mahajäämus keskmisest kasvunormist.
Hüpofüüsi kääbuskasvu iseloomustab lisaks väikesele absoluutsele kehasuurusele ka väike aastane kasv ja füüsilise arengu dünaamika. Kehaehitus on proportsionaalne, kuid patsientide keha proportsioonid on lapsepõlvele tüüpilised. Nahk on kahvatu, sageli kollaka varjundiga, kuiv, mis on tingitud kilpnäärme absoluutsest või suhtelisest puudulikkusest, mõnikord täheldatakse tsüanoosi - naha "marmoreerumist". Ravimata patsientidel ilmneb varakult vananenud ja kortsus nahk (geroderma). See on tingitud STH anaboolse toime puudulikkusest ja rakupõlvkondade aeglasest vahetusest.
Peanaha juuksed võivad olla normaalsed või kuivad, õhukesed, haprad; tüüpilised on pikad ripsmed. Teisene karvakasv sageli puudub. Enamikul kääbuskasvuga patsientidest (70–75%) ei ole turjakitse suurus muutunud, kuid turjakitse säilitab sageli lapseliku "seisva ovaali" kuju, sellel on lai "juveniilne" selg ja kiiluluu siinus jääb pneumatisatsiooni osas maha. Siiski on patsiente, kellel on suurenenud turjakitse, mis on kasvaja tunnus; selle taustal või sissepääsu piirkonnas on kaltsifikatsioonialad (kraniofarüngioomi, neuroinfektsiooni jääknähtude korral) või selle vähenemine (alaarengu tunnused, hüpofüüsi väiksus). Täheldatakse koljusisese hüpertensiooni sümptomeid: koljuvõlvi luude hõrenemine, suurenenud veresoonte muster, sõrmejälgede olemasolu jne. Hüpofüüsi kääbuskasvu kõige olulisem tunnus on skeleti diferentseerumise ja luustumise ajastuse hilinemine. Ka hambasüsteemi tunnused on tihedalt seotud skeleti diferentseerumisega: täheldatakse piimahammaste hilinenud vahetumist. Suurim skeleti arengu mahajäämus on täheldatud kääbushaigusega patsientidel, kellel on seksuaalne puudulikkus ja hüpotüreoidism.
Enamiku patsientide suguelundid on tugevalt alaarenenud, kuigi väärarengud on haruldased. Täheldasime krüptorhidismi 5,8%-l meespatsientidest. Seksuaalse puudulikkusega kaasneb sekundaarsete sugutunnuste alaarenenud areng ja seksuaalse iha vähenemine, menstruatsiooni puudumine. Normaalset spontaanset seksuaalset arengut täheldatakse ainult isoleeritud kasvuhormooni puudulikkusega patsientidel ja mõnedel ajukääbuskasvuga patsientidel.
Kilpnäärme puudulikkus on üsna levinud kääbuskasvu sümptom. Tuleb märkida, et hüpotüreoidismi välised ilmingud ei kajasta alati kilpnäärme tegelikku funktsionaalset seisundit. See on tingitud suhtelisest hüpotüreoidismi, mis on tingitud türoksiini (T4) ülemineku rikkumisest trijodotüroniiniks (T3 ) ja inaktiivse (pöörduva)T3 moodustumisest, mis on iseloomulik somatotroopsele puudulikkusele.
Adrenokortikotroopne funktsioon hüpofüüsi kääbuskasvu korral väheneb harvemini ja vähemal määral kui sugu ja kilpnääret stimuleerivad funktsioonid ning enamikul patsientidest ei vaja see spetsiaalset korrektsiooni.
Enamasti ei ole intellekt häiritud. Esineb emotsionaalseid muutusi vaimse infantilismi vormis; vanematel patsientidel, kellel intellektuaalne kahjustus puudub, täheldatakse mõnikord reaktiivseid neuroose.
Orgaanilises ajupatoloogias, eriti kasvaja iseloomuga, võib kääbuskasvu esineda koos diabeedi insipidus'e, bitemporaalse hemianopsia ja intellektipuudega.
Kesknärvisüsteemi orgaaniliste sümptomiteta patsientidel aju bioelektrilise aktiivsuse arengu uuring näitas, et nende EEG-d iseloomustavad ebaküpsuse tunnused, kõrge "lapseliku" EEG-pinge pikaajaline säilimine; alfa-rütmi ebaühtlus amplituudis ja sageduses; aeglaste θ- ja δ-rütmide sisalduse järsk tõus, eriti frontaal- ja tsentraalsetes juhtmetes; selge reaktsioon hüperventilatsioonile; valguse stimulatsiooni rütmidele järgnevate EEG-rütmide ulatuse nihkumine madalate sageduste suunas (tõendid aju närvistruktuuride funktsionaalse liikuvuse vähenemisest). Selgus, et vanematel patsientidel on aju elektrilise aktiivsuse ebaküpsus tingitud seksuaalsest alaarengust ja igas vanuses patsientidel - hüpotüreoidismi.
Kääbuskasvuga patsientidel esineb süsivesikute ainevahetuse halvenemist, millele on iseloomulik kalduvus tühja kõhu veresuhkru taseme langusele, selle tõus füüsilise koormuse ajal, endogeense insuliini puudulikkus, suurenenud tundlikkus eksogeense insuliini suhtes koos sagedase hüpoglükeemiliste seisundite tekkega. Viimast seletatakse peamiselt patsientide kehas ebapiisava insuliinitasemega.
Siseorganitel esineb splanhnomükria ehk suuruse vähenemine. Kääbuskasvule omaseid siseorganite funktsionaalseid muutusi ei ole kirjeldatud. Sageli täheldatakse arteriaalset hüpotensiooni koos süstoolse ja diastoolse rõhu languse ning pulsi amplituudi vähenemisega. Südamehelid on summutatud, kuulda on erinevate teemade funktsionaalseid kahinaid, mis on tingitud müokardi troofilistest muutustest ja autonoomsetest häiretest. EKG-le on iseloomulik madal voltaaž (eriti hüpotüreoidismi korral), siinusbradükardia või bradüarütmia; PCG-l on näha toonide amplituudi vähenemine, lisatoonid ja funktsionaalsed kahinad. Oksügeomeetria andmed näitavad hüpokseemiat (algselt ja füüsilise koormuse ajal) ja hapnikuvõlga. Eakatel patsientidel tekib mõnikord hüpertensioon.
Diagnostika kääbus
Kääbuskasvu diagnoosimine ja diferentsiaaldiagnoos põhineb anamneesi andmetel ning põhjalikul kliinilisel, radioloogilisel, laboratoorsel ja hormonaalsel uuringul. Lisaks absoluutsele kehasuurusele määratakse patsientide kasvu hindamiseks kasvudefitsiit – erinevus patsiendi pikkuse ja tema vastava soo ja vanuse keskmise normi vahel; kasvuiga – patsiendi pikkuse vastavus teatud standarditele; normaliseeritud hälbe näitaja.
I = M - Mcp / δ, kus M on patsiendi pikkus, Mcp on antud soo ja vanuse keskmine normaalne pikkus, δ on Mcp-st ruuthälve; I alla 3 on tüüpiline nanismile, I üle 3 on tüüpiline gigantismile. Seda näitajat saab kasutada arengu dünaamika hindamiseks.
Kääbuskasvuga patsientide röntgenülesvõttel ilmnevad koljusisese hüpertensiooni tunnused, neuroinfektsiooni jääknähud, kaltsifikatsioonid ja kraniosünostoosi tunnused. Hüpofüüsi suurust iseloomustavaks kaudseks näitajaks peetakse türgi keele suuruse, kuju ja struktuuri uurimist. Üks olulisemaid patoloogilise kasvupeetuse ilminguid on skeleti diferentseerumise rikkumine. Skeleti küpsuse astme hindamiseks määratakse luu (radiograafiline) vanus, mis vastab luukoe diferentseerumisele; luustumispuudulikkus on luustumise normist mahajäämuse aste (aastates), luustumiskoefitsient on luu vanuse jagamine kronoloogiliste ja muude parameetritega.
Dwarfismi tänapäevane diagnostika on võimatu ilma somatotroopse hormooni sekretsiooni, selle basaaltaseme, ööpäevase rütmi ja stimulatsiooni mõjul vabanemise uurimiseta. Enamikule hüpofüüsi dwarfismiga patsientidest on iseloomulik somatotroopse hormooni vähenenud sisaldus vereseerumis. Radioimmunoloogilise meetodi abil määratuna on see (erinevate autorite andmetel) vahemikus (0,87±0,09) kuni (1,50±0,64) ng/ml, keskmise normiga (3,81±0,29) ng/ml. Somatotroopse hormooni sekretsiooni ööpäevase (ööpäevase) rütmi uuring näitas, et tervetel inimestel on selle tase maksimaalne esimese kahe unetunni jooksul ja kell 4-6 hommikul. Dwarfismi korral on somatotroopse hormooni sisaldus ka nendel tundidel vähenenud.
Somatotroopse funktsiooni reservide uurimiseks kasutatakse erinevaid stimulante, uurides somatotroopse hormooni sisaldust enne ja pärast nende manustamist. Uuringuks võetakse verd iga 30 minuti järel 2-3 tunni jooksul. Somatotroopse hormooni vabanemist pärast stimulatsiooni peetakse normaalseks vähemalt kuni 7-10 ng/ml, mõnikord ulatub see 20-40 ng/ml-ni. Kui ühes proovis reaktsiooni ei esine, tehakse korduvad testid teiste stimulantidega. Somatotroopse hormooni puudulikkus loetakse tõestatuks, kui somatotroopset hormooni ei ole 2-3 erinevas proovis vabanenud.
Kõige sagedamini kasutatavad stimuleerivad testid on: insuliini intravenoosse manustamise korral annuses 0,1 U (0,75–1,5 U) 1 kg patsiendi kehakaalu kohta ja hüpoglükeemia (vere glükoositaseme langus 50% võrreldes algtasemega) saavutamisel määratakse seerumi somatotroopne hormoon ülaltoodud skeemi järgi. Raske hüpoglükeemia korral test katkestatakse ja patsiendile manustatakse glükoosi intravenoosselt. See on kõige levinum klassikaline diagnostiline meetod.
TRH annuses 200–500 mcg intravenoosselt. Tuvastab tõhusalt hormoonreservid, ei põhjusta tüsistusi. Koos insuliinitestiga võimaldab see hinnata hüpotaalamuse-hüpofüüsi süsteemi kahjustuse taset. Positiivne reaktsioon TRH-le insuliini puudumisel viitab hüpoglükeemiale, mis viitab hüpofüüsi tervena püsimisele ja kahjustusele hüpotaalamuse tasandil, negatiivne reaktsioon TRH-le ja hüpoglükeemiale viitab hüpofüüsi enda kahjustusele.
TRH, LH-RH annuses 300 mcg intravenoosselt on sarnane eelmisele.
Inimese SGH on kõhunäärmekasvajast eraldatud bioloogiliselt aktiivse ühendi sünteetiline analoog. Praegu on 3 tüüpi sünteetilist SGH-d: 29, 40 ja 44 aminohappejäägiga. Seda kasutatakse intravenoosselt annustes 1 kuni 3 μg/kg patsiendi kehakaalu kohta. STH vabanemist täheldatakse 15-20 minutit pärast manustamist, test on endogeense kasvuhormooni reservide tuvastamisel teistest efektiivsem. Positiivne SGH reaktsioon näitab hüpotaalamuse somatotroopse funktsiooni kahjustuse taset ja tervet hüpofüüsi; aminohapetega (L-arginiinmonokloriid, ornitiin, trüptofaan, glütsiin, leutsiin) intravenoosselt annuses 0,25-0,5 g 1 kg patsiendi kehakaalu kohta. Efektiivne SGH reservide uurimiseks. Võib põhjustada allergilisi reaktsioone.
L-dopa suukaudselt annuses 250–500 mcg. Efektiivne, patsientide poolt hästi talutav.
Kasutatakse ka teste glükagooni, broomi ergokrüptiini (parlodel), lüsiini vasopressiini, klonidiini ja doseeritud jalgrattaergomeetrilise koormusega.
Somatotroopse funktsiooni seisundi uurimine on vajalik mitte ainult kääbuskasvu diagnoosimiseks, vaid ka ravimeetodi põhjendatud valikuks, kuna somatotropiiniga ravi on ratsionaalne ainult endogeense kasvuhormooni puudulikkuse korral.
Dwarfismi vormi diagnoosimiseks on väga oluline uurida insuliinilaadsete kasvufaktorite ehk somatomediinide (eriti IGF-1 ehk somatomediin C) sisaldust – need on somatotroopse hormooni toime mediaatorid koe tasandil. On teada, et dwarfismi korral on somatomediin C sisaldus normist madalam ja akromegaalia korral kõrgem. Laroni kirjeldatud dwarfismi vorm on haigus, mille puhul on normaalne kasvuhormooni tootmine, kuid IGF-1 ja IGF-II moodustumine on häiritud. Selliste patsientide ravi somatotropiiniga on mõttetu.
Hüpofüüsi somatotroopse funktsiooni kaudsed näitajad on aluselise fosfataasi aktiivsus ja anorgaanilise fosfori sisaldus seerumis. Hüposomatotroopsete seisundite korral on need näitajad vähenenud. Panhüpopituitaarse kääbuskasvu vormi korral väheneb gonadotropiinide, sageli TSH, sekretsioon, millega kaasneb vastav sugunäärmete (androgeenide või östrogeenide puudulikkus), kilpnäärme (T3 , T4 , valgudega seotud joodi - PBI taseme langus,131I akumuleerumine kilpnäärmes) ja neerupealiste (kortisooli ja 17-OCS hulga vähenemine plasmas, 17-KC ja 17-OCS eritumine uriiniga, lümfotsütoos) funktsioonide langus.
Kõikidele hüpofüüsi (hüpotalamuse-hüpofüüsi) geneetilisele kääbuskasvule on iseloomulik laste korduv haigus perekonnas, kus pärandumine toimub autosomaalselt retsessiivselt (sagedamini) või autosomaalselt dominantselt, kasvupeetus ja füüsiline areng alates 2. eluaastast, kusjuures mahajäämus on vähemalt 2-3 kraadi antud soo, vanuse ja populatsiooni keskmisest kasvunormist, madal spontaanne aastane kasvudünaamika ja hilinenud luustumine. Madala somatotroopse hormooni taseme korral (2-3 stimuleerivas testis alla 7 ng/ml) on somatotroopse hormooniga ravi väga efektiivne (annab kasvu vähemalt 7 cm aastas). Normaalse või kõrge somatotroopse hormooni taseme korral (koos bioloogilise inaktiivsusega) on võimalik säilitada tundlikkus hormooni suhtes. Intellekti muutusi ei täheldata.
Geneetilise kääbuskasvu korral, millega kaasneb koe tundlikkus somatotroopse hormooni suhtes, on kliiniline pilt sarnane isoleeritud kasvuhormooni puudulikkusega, kuid somatotropiinravi on ebaefektiivne. Selles rühmas saab IRF taseme järgi eristada järgmisi peamisi vorme: normaalse sisaldusega (IRF retseptori defekt) ja vähenenud - Laroni tüüpi kääbuskasvu (IRF-1 ja IRF-II puudulikkus) ning Aafrika pügmeedel esinev tüüp (IRF-1 puudulikkus).
Tserebraalset kääbuskasvu iseloomustavad isoleeritud haigused perekonnas, mis on seotud kesknärvisüsteemi emakasisese või postnataalse kahjustusega, kusjuures esinevad ilmsed orgaanilised muutused kesknärvisüsteemis, sageli kombineerituna nägemisorgani patoloogiaga, diabeedi insipiduse esinemisega, gonadotroopsete funktsioonide säilimisega ja intelligentsuse muutustega.
Mõned sugunäärmete düsgeneesi ja ageneesi tüübid kaasnevad märgatava lühikese kasvuga, eriti Šereševski-Turneri sündroom ja munandite düsgeneesi sündroomi "Turneroid" (mosaiikne) vorm. Tsütogeneetilised uuringud (sugukromatiin, karüotüüp) aitavad diferentsiaaldiagnoosis, paljastades kromosomaalsed defektid, samuti somaatiliste ja seksuaalse arengu iseloomulikud defektid, endogeense somatotroopse hormooni normaalse või kõrgenenud taseme ning somatotropiinravi suhtes tundlikkuse puudumise.
Lühikese kasvuga kaasnevate endokriinsete häirete hulgas tuleks välja tuua primaarne hüpotüreoidismi, mis on põhjustatud kilpnäärme kaasasündinud hüpoplaasiast või aplaasiast, selle düstoopiast, kilpnäärmehormoonide biosünteesi ensümaatilistest defektidest ja kilpnäärme varajasest autoimmuunkahjustusest. Kõigis neis seisundites domineerivad hüpotüreoidismi tunnused koos kõrge TSH tasemega, T4 ja T3 vähenemisega vereseerumis . Autoimmuunse tekkegamüksedeemi korral tuvastatakse veres türeoglobuliini, kilpnäärmekoe mikrosomaalsete ja tuumafraktsioonide vastased antikehad, somatotroopse hormooni tase on normaalne või vähenenud. Kliinilist efekti saab saavutada ainult hüpotüreoidismi kompenseerimisega.
Lühikese kasvuga kaasneb enneaegne seksuaalne areng ja adrenogenitaalne sündroom, mis on tingitud kasvuvööndite varajasest sulgumisest; Itsenko-Cushingi tõbi, mis tekib lapsepõlves glükokortikoidide pärssiva toime tõttu somatotroopse hormooni sekretsioonile ja nende kataboolsele toimele; Mauriaci sündroom - raske insuliinsõltuva suhkurtõvega patsientide lühike kasv ja infantilism.
Hüpofüüsi kääbuskasvu tuleks eristada somatogeensest füüsilise arengu hilinemisest, mis on põhjustatud kroonilistest ainevahetushäiretest (maksa-, neeru-, seedetraktihaiguste korral), kroonilisest hüpoksiast (südame-veresoonkonna ja hingamissüsteemi haiguste korral, aneemia korral); lihasluukonna süsteemsete haigustega (kondrodüstroofia, osteogenees, eksostoos) jne.
Funktsionaalset (konstitutsioonilist) kasvupeetust täheldatakse mõnikord puberteedi hilise algusega pealtnäha tervetel noorukitel; oleme leidnud, et see on peamiselt seotud gonadotroopse aktiivsuse mööduva puudulikkusega. Somatotroopse hormooni sekretsioon tavaliselt ei ole häiritud või on veidi vähenenud. Gonadotropiinide stimuleerimine võib kiirendada nii seksuaalset arengut kui ka kasvu.
Perekonna iseloomuga lühikest kasvu tuleks pidada füsioloogilise arengu variandiks.
Mida tuleb uurida?
Kuidas uurida?
Millised testid on vajalikud?
Kellega ühendust võtta?
Ravi kääbus
Kääbuskasvu ravi on pikk protsess. See sunnib arsti jaotama kasvu mõjutamise vahendeid aja jooksul, et saavutada suurim kliiniline efekt, järgides samal ajal kahte põhiprintsiipi:
- ravist tingitud arengu maksimaalne lähendamine füsioloogilistele tingimustele;
- epifüüsi kasvutsoonide säästmine.
Pikaajaline kogemus kääbuskasvu ravis lubab meil pidada sobivaks järgmist etapiviisilise ravi skeemi. Täiskasvanud patsientidel kääbuskasvu diagnoosimine tavaliselt kahtlusi ei tekita. Väikelastel on ebaselge kliinilise pildi korral vajalik diagnostiline periood: 6-12 kuud jälgimise all ilma hormoonravita. Selle aja jooksul on ette nähtud kompleksne üldtugevdav ravi; piisav toitumine koos loomse valgu, köögiviljade ja puuviljade sisalduse suurendamisega toidus, A- ja D-vitamiinide, kaltsiumi- ja fosforipreparaatide lisamisega. Hormoonravi alustamise aluseks on piisavate muutuste puudumine kasvus ja füüsilises arengus selle taustal ning endokriinsete häirete avastamine uuringu käigus.
Hüpofüüsi kääbuskasvu peamiseks patogeneetiliseks ravimeetodiks on inimese kasvuhormooni kasutamine, kuna enamiku kääbuskasvu juhtude esinemine sõltub kahtlemata ühest või teisest selle puudulikkuse vormist. Selle hormooni liigispetsiifilisuse tõttu on inimestele aktiivne ainult inimese ja primaadi somatotropiin. Kliinikus kasutatakse laialdaselt ravimit, mis on eraldatud mittenakkuslikesse ja mittekasvajalikesse haigustesse surnud inimeste hüpofüüsist. Inimese somatotropiin saadakse bakteriaalse sünteesi teel, kasutades geenitehnoloogia abil Escherichia coli. Inimese somatotropiini sünteesitakse ka keemiliselt, kuid see on äärmiselt kallis ja kliinikus praktiliselt ei kasutata. Somatotropiinraviks valitakse patsiendid, kellel on tõestatud endogeense kasvuhormooni puudulikkus, mille skeleti diferentseerumine ei ületa 13–14-aastastele tüüpilist taset. Ravi vanusepiiranguid ei ole.
Ravi esimesel perioodil kasutatavad minimaalsed efektiivsed annused on 0,03–0,06 mg/kg kehakaalu kohta. Kõige efektiivsemad annused on 2–4 mg 3 korda nädalas. Ühekordse annuse suurendamine 10 mg-ni ei kaasnenud kasvuefekti piisava suurenemisega, kuid põhjustas somatotropiini vastaste antikehade kiire tekke.
Meie riigis on inimese kasvuhormooni uurimistööd tehtud alates 1960. aastast. Testitud on kahte raviskeemi: pidevat ja vahelduvat, 2-3-kuuliste kuuridega ja samade intervallidega nende vahel. Patsientide keskmine pikkuse tõus esimesel raviaastal oli 9,52±0,39 cm, kehakaalu tõus 4,4±0,14 kg. Pikaajalise pideva ravi korral oli keskmine pikkuse tõus 0,82 cm/kuus ja kehakaalu tõus 0,38 kg/kuus; vahelduva ravi korral vastavalt 0,75 cm/kuus ja 0,4 kg/kuus. Pidev ravi tagas kiirema pikkuse tõusu, mille mõju vähenes järsult 1-1,5 aasta pärast, vahelduva ravi korral püsis efektiivsus 3-4 aastat, mis võimaldab meil pidada ravikuuri sobivamaks. IGF-I (somatomediin C) taseme määramine võib olla usaldusväärne näitaja patsiendi tundlikkusest somatotropiinravimitega ravi suhtes. IGF-I sisalduse suurenemine pärast somatotroopse hormooni kasutuselevõttu võimaldab ennustada ravi positiivset mõju. Somatotropiinravi oluline eelis on skeleti luustumise kiirenemise puudumine selle taustal.
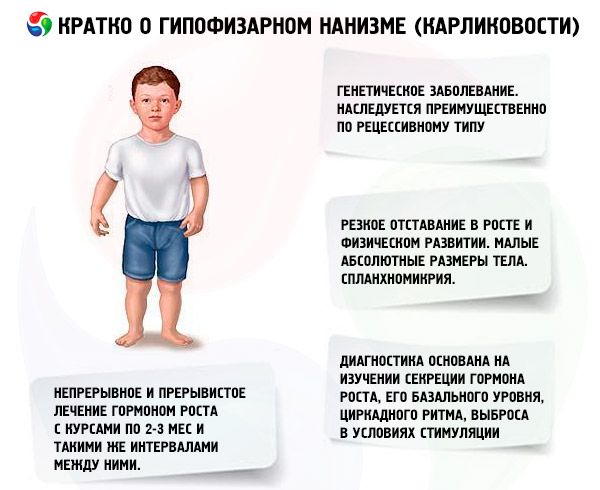
Kõige olulisem vahend kääbuskasvu ravis on anaboolsete steroidide kasutamine, mis stimuleerivad kasvu, suurendades valgusünteesi ja suurendades endogeense somatotroopse hormooni taset. Ravi viiakse läbi mitu aastat, asendades mõned ravimid järk-järgult teistega, vähem aktiivsetelt ühenditelt aktiivsematele. Anaboolsete ravimite vahetamine on näidustatud, kui kasvuefekt väheneb 2-3 aasta pärast, mis viib kasvu täiendava suurenemiseni. Ravi viiakse läbi kuuridena (puhkeperiood peaks olema pool raviperioodist). Sõltuvuse korral on näidustatud ka pikemad pausid (kuni 4-6 kuud). Korraga määratakse ainult üks anaboolne steroid. Kahe või enama ravimi kombineerimine ei ole kohane, kuna see ei suurenda nende ainevahetus- ja kasvuefekti. Viimane sõltub peamiselt patsientide vanusest ja skeleti luude diferentseerumise astmest ravi alguses. Parimat efekti täheldatakse alla 16-18-aastastel patsientidel, kelle skeleti luustumine ei ületa 14-aastasele iseloomulikku taset. Ravi on soovitatav alustada kohe pärast diagnoosi saamist, tavaliselt 5-7-aastaselt. Enne ravi on vaja vältida gonadotropiinide ja suguhormoonide määramist, mis stimuleerivad kasvu, kuid kiirendavad samaaegselt skeleti diferentseerumist. Anaboolsete steroidide annustamise põhimõte on minimaalsest efektiivsest annusest järk-järgult suurenevate annusteni. Kõige levinumate ravimite soovitatavad annused on: nerobool (metandrostenool, dianabol) - 0,1–0,15 mg 1 kg kehakaalu kohta päevas suu kaudu; neroboliil (durabolin) - 1 mg 1 kg kehakaalu kohta kuus intramuskulaarselt, igakuine annus manustatakse vastavalt 2–3 annusena 15 või 10 päeva pärast; retaboliil (deka-durabolin) - 1 mg 1 kg kehakaalu kohta üks kord kuus intramuskulaarselt. Määratud annuste ületamine võib viia androgeniseerumiseni. Füsioloogilistes annustes ei mõjuta need ühendid oluliselt suguelundite seisundit ja skeleti luude diferentseerumist, mis võimaldab neid pikka aega kasutada mõlema soo patsientidel. Tüdrukud peaksid olema günekoloogi järelvalve all, kuna üledoosi või suurenenud individuaalse tundlikkuse korral võivad mõnedel patsientidel tekkida viriliseerumise tunnused, mis ravi lõpetamisel kiiresti taanduvad. 17. positsioonis etüleeritud metüülitud suukaudsed ravimid võivad mõnikord põhjustada kolestaatilist toimet, seetõttu tuleks maksahaiguste korral eelistada parenteraalseid anaboolseid ühendeid või kombineerida suukaudseid ravimeid kolereetiliste ainetega. Väga harva võib anaboolsete steroididega ravi põhjustada allergilisi reaktsioone (sügelus, lööve). Tüsistuste puudumisel kasutatakse anaboolseid steroide seni, kuni täheldatakse kasvuefekti (kuni 16-18 aastat ja mõnikord kauem). Ravi viiakse läbi üldise tugevdava ravi taustal.
Kui patsientidel on hüpotüreoidismi tunnuseid, määratakse kilpnäärme ravimid (türoksiin, türeoidiin, türotom) samaaegselt individuaalselt valitud annustes.
Poiste ravis on järgmiseks sammuks inimese kooriongonadotropiini manustamine. Seda ravimit kasutatakse mitte varem kui 15-16 aasta vanuselt ja sageli veelgi hilisemas eas Leydigi rakkude stimuleerimiseks, mis kiirendab nii seksuaalset arengut kui ka kasvu (oma androgeenide anaboolse aktiivsuse tõttu). Annuseid 1000 kuni 1500 RÜ kasutatakse 1-2 korda nädalas intramuskulaarselt 2-kuuliste kuuridena mitte rohkem kui 2-3 korda aastas. Kui toime on puudulik, vaheldub ravi inimese kooriongonadotropiiniga 16-aastastel ja vanematel poistel väikeste androgeenide annuste manustamisega (metüültestosteroon annuses 5-10 mg/päevas keele all).
Üle 16-aastased tüdrukud võivad ravi alustada väikeste östrogeeniannustega, mis simuleerivad normaalset seksuaaltsüklit. Ravi viiakse läbi iga kuu 3 nädalat, millele järgneb paus. Tsükli teises faasis, alates 3. nädalast, võib määrata kooriongonadotropiini annuses 1000–1500 RÜ 3–5 korda nädalas või progesterooni toimega ravimeid (pregniin, progesteroon).
Ravi viimane etapp (pärast kasvutsoonide sulgemist) on patsiendi soole vastavate suguhormoonide terapeutiliste annuste pidev manustamine, et täielikult arendada välja suguelundeid, sekundaarseid sugutunnuseid, tagada libiido ja seksuaalne potentsi. Naispatsientide raviks sobivad kombineeritud östrogeeni-progestageeni preparaadid (non-ovlon, bisekurin, infekundin, rigevidon) ja meespatsientide raviks pikatoimelised androgeenipreparaadid (testenaat, sustanon-250, omnadren-250).
Üldine tugevdav ravi viiakse läbi (režiim, valgu-köögivilja dieet, vitamiinravi, biostimulandid). Näidustatud on tsingipreparaatide kasutamine, mille toimemehhanismis on peamine roll IGF-1 (insuliinilaadne kasvufaktor I) aktiivsuse suurendamisel.
Kesknärvisüsteemi orgaanilise patoloogia esinemisel manustatakse põletikuvastast, resorptsioonilist ja dehüdratsiooniravi. Sihipärane süstemaatiline ravi annab julgustava efekti. Pikaajalise etapiviisilise ravi tulemusena õnnestus 175-st mõlema soo kääbuskasvuga patsiendist 148-l (80,4%) saavutada pikkus üle 130 cm, 92-l (52,5%) üle 140 cm ja 32-l (18,3%) 150–160 cm või rohkem. Samal ajal suurenes 37 patsiendi (21,2%) pikkus 30 cm, 107-l (61,1%) 31–50 cm ja 31-l (17,7%) 51–60 cm või rohkem.
Prognoos
Prognoos sõltub kääbuskasvu vormist. Geneetiliste kääbuskasvu tüüpide korral on eluprognoos soodne. Hüpofüüsi kasvaja ja kesknärvisüsteemi orgaanilise kahjustuse korral määrab selle peamise patoloogilise protsessi arengu dünaamika. Kaasaegsed ravimeetodid on oluliselt suurendanud patsientide füüsilisi võimeid ja töövõimet ning pikendanud nende eluiga. Aktiivse ravi perioodil peavad patsiendid käima arsti juures läbivaatusel iga 2-3 kuu tagant, säilitusravi korral iga 6-12 kuu tagant.
Patsientide sotsiaalse kohanemise seisukohalt on ülioluline nende töölevõtmine vastavalt nende intellektuaalsetele ja füüsilistele võimetele.
Soovitav on valida elukutsed, mis ei ole seotud suure füüsilise koormusega, kuid võimaldavad teil näidata intellektuaalseid võimeid, täpse töö tegemise oskust ja keeli.


 [
[