Artikli meditsiiniline ekspert
Uued väljaanded
Hüpofüüsi mikroadenoom: põhjused, sümptomid, oht, prognoos
Viimati vaadatud: 12.07.2025

Kõik iLive'i sisu vaadatakse meditsiiniliselt läbi või seda kontrollitakse, et tagada võimalikult suur faktiline täpsus.
Meil on ranged allhanke juhised ja link ainult mainekate meediakanalite, akadeemiliste teadusasutuste ja võimaluse korral meditsiiniliselt vastastikuste eksperthinnangutega. Pange tähele, et sulgudes ([1], [2] jne) olevad numbrid on nende uuringute linkideks.
Kui tunnete, et mõni meie sisu on ebatäpne, aegunud või muul viisil küsitav, valige see ja vajutage Ctrl + Enter.
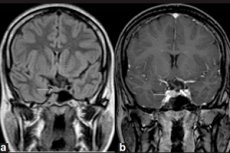
Endokriinsetes näärmetes tekkivaid healoomulisi kasvajaid nimetatakse adenoomideks ja hüpofüüsi mikroadenoom on selle eesmise lobe väike kasvaja, mis toodab mitmeid olulisi hormoone.
Epidemioloogia
Hüpofüüsi kasvajate esinemissagedus on hinnanguliselt 10–23% ja kõige levinumad on hüpofüüsi adenoomid, millel võivad olla mitmesugused kujud ja suurused (16%).[ 1 ]
Kuni 20–25%-l inimestest võib esineda väikeseid hüpofüüsi kasvajaid, mikroadenoome, seda isegi teadmata, ja umbes pooltel juhtudel avastatakse sellised kasvajad juhuslikult aju pildistamise käigus.
Prolaktiini eritavad mikroadenoomid moodustavad 45–75% sellistest kasvajatest; AKTH-d tootvad moodustised moodustavad mitte rohkem kui 14% juhtudest ja STH-d tootvate mikroadenoomide esinemissagedus ei ületa 2%.
Hüpofüüsi mikroadenoom lastel ja noorukitel avastatakse 10,7–28% juhtudest ning vähemalt pooled neist on hormonaalselt mitteaktiivsed. [ 2 ]
Põhjused hüpofüüsi mikroadenoomid
Eksperdid ei tea täpselt mikroadenoomi ilmnemise põhjuseid hüpofüüsis , mis on aju endokriinne nääre, mille rakud toodavad:
- kortikotropiin ehk AKTH – adrenokortikotroopne hormoon, mis põhjustab neerupealise koore poolt steroidhormoonide sekretsiooni;
- kasvuhormoon STH – somatotroopne hormoon;
- gonadotropiinid FSH – folliikuleid stimuleeriv hormoon ja LH – luteiniseeriv hormoon, mis määravad naissuguhormoonide tootmise munasarjades ja meessuguhormoonide tootmise munandites;
- laktogeenne hormoon prolaktiin (PRL);
- türeotropiin ehk kilpnääret stimuleeriv hormoon (TSH), mis stimuleerib kilpnäärme hormoonide sünteesi.
Arvatakse, et nende kasvajate arengut võivad põhjustada traumaatiline ajukahjustus; hüpofüüsi ebapiisav verevarustus; ajuinfektsioonid või kokkupuude toksiinidega (põhjustades turset ja koljusisene hüpertensioon).
Riskitegurid
On teada, et hüpofüüsi adenoomid ja mikroadeenoomid esinevad sagedamini MEN 1 sündroomi – 1. tüüpi hulgiseeruva endokriinse adenomatoosi – perekonnaanamneesi korral, mis on pärilik. Seega on olemas geneetiliselt määratud riskifaktorid, mis on seotud teatud muutustega DNA-s. [ 3 ]
4. tüüpi hulgisekretsiooni neoplaasia (MEN4): MEN 4-l on mutatsioon tsükliin-sõltuva kinaasi inhibiitori 1B (CDKN1B) geenis, mida iseloomustavad hüpofüüsi kasvajad, hüperparatüreoos ning munandite ja emakakaela neuroendokriinsed kasvajad.[ 4 ]
Carney kompleks (CNC): Carney kompleksis esineb tuumorsupressorgeenis PRKAR1A iduliini mutatsioon, mis põhjustab primaarset pigmenteerunud nodulaarset neerupealisekoore haigust (PPNAD), munandikasvajaid, kilpnäärme sõlmi, naha laikulist hüperpigmentatsiooni ja akromegaaliat.[ 5 ]
Perekondlike isoleeritud hüpofüüsi adenoomide (FIPA) kliinilist vormi iseloomustavad arüülsüsivesiniku retseptoriga interakteeruva valgu (AIP) geeni geneetilised defektid, mida esineb ligikaudu 15%-l kõigist sugulussidemetega ja 50%-l homogeensetest somatotropiini perekondadest.[ 6 ]
Perekondlikud isoleeritud hüpofüüsi adenoomid (FIPA): Arüülsüsivesiniku retseptoriga interakteeruva valgu (AIP) mutatsioon avastatakse noorukieas või varases täiskasvanueas ligikaudu 15%-l kõigist FIPA juhtudest. Need kasvajad on tavaliselt agressiivsed ja eritavad enamasti kasvuhormooni, põhjustades akromegaaliat.[ 7 ]
Ei ole välistatud, et seda tüüpi kasvaja tekib teiste endokriinsete näärmete ja aju struktuuride funktsionaalsete häirete tagajärjel, eriti hüpotalamuse veresoonte süsteemi muutuste tõttu, mis neuroendokriinse hüpotaalamuse-hüpofüüsi süsteemi raames reguleerib hüpofüüsi ja selle eesmise lobe, adenohüpofüüsi, tööd koos selle vabastavate hormoonidega.
Pathogenesis
Histoloogia järgi on hüpofüüsi adenoom healoomuline kasvaja; olenevalt suurusest jagunevad need kasvajad mikroadenoomideks (kuni 10 mm läbimõõduga kõige laiemas kohas), makroadenoomideks (10–40 mm) ja hiiglaslikeks adenoomideks (40 mm või rohkem).
Kasvaja moodustumise patogeneesi uurimisel hüpofüüsis ei ole veel olnud võimalik kindlaks teha selle eesmise lobe rakkude hüperplastilise transformatsiooni mehhanisme kasvajaks.
Eksperdid usuvad, et üks veenvamaid versioone on seos neurotransmitteri ja hormooni dopamiini (mis on prolaktiini sekretsiooni peamine inhibiitor) metabolismi dereguleerimisega ja/või PRL-i (laktotroofe) eritavate hüpofüüsirakkude transmembraansete dopamiini retseptorite funktsioonide häirega.
Enamik hüpofüüsi mikroadenoome on juhuslikud, kuid mõned esinevad osana geneetiliselt määratud neuroendokriinsetest sündroomidest, nagu MEN 1, McCune-Albrighti sündroom, Werneri sündroom ja Carney sündroom (või Carney kompleks). Viimane on seotud suurenenud riskiga healoomuliste kasvajate tekkeks hormonaalsetes (endokriinsetes) näärmetes, sealhulgas hüpofüüsis, neerupealistes, kilpnäärmes, munasarjades ja munandites.
Sümptomid hüpofüüsi mikroadenoomid
Hüpofüüsi mikroadenoom ei pruugi väga pikka aega mingeid sümptomeid ilmutada. Sümptomid varieeruvad olenevalt asukohast ja tekivad tavaliselt endokriinse düsfunktsiooni tagajärjel. See on kõige levinum leid hormonaalse tasakaalutuse korral, mis on seotud ühe või mitme hormooni liigse tootmisega. Enamasti on see asukoha järgi hüpofüüsi eessagara mikroadenoom.
Hüpofüüsi mikroadenoome on erinevat tüüpi, mis põhinevad nende hormonaalsel aktiivsusel. Seega peetakse kõige levinumaks tüübiks mittetoimivat adenoomi – hormonaalselt inaktiivset hüpofüüsi mikroadenoomi, mis kuni teatud suuruse saavutamiseni ei anna mingeid sümptomeid. Kuid kasvav hormonaalselt inaktiivne hüpofüüsi mikroadenoom võib suruda kokku lähedalasuvaid ajustruktuure või kraniaalnärve, seega võivad hüpofüüsi mikroadenoom ja peavalud otsmiku- ja oimuspiirkonnas kombineerida [ 8 ] ning võimalikud on ka nägemisprobleemid. [ 9 ] Nagu teadlased aga väidavad, on mittetoimivad (hormonaalselt inaktiivsed) hüpofüüsi kasvajad 96,5% juhtudest makroadeenoomid. [ 10 ]
Võib esineda ka hüpofüüsi (selle eesmise lobe) hormonaalselt aktiivne mikroadenoom koos hormooni prolaktiini suurenenud sekretsiooniga - hüpofüüsi prolaktinoom. PRL-i suurenenud tootmist adenohüpofüüsi laktotroopsete rakkude poolt defineeritakse kui hüperprolaktineemiat hüpofüüsi mikroadenoomis.
Kuidas selline hüpofüüsi mikroadenoom naistel avaldub? Selle hormooni patoloogiliselt kõrge tase pärsib östrogeenide tootmist ning esimesed nähud avalduvad menstruaaltsükli häiretena - menstruatsiooni puudumisega (amenorröa) ja/või nende ovulatsioonifaasiga. Selle tagajärjel tekib püsiv galaktorröa-amenorröa sündroom ning kaob võime rasestuda ja rasestuda.
Meestel esinev prolaktiini eritav hüpofüüsi mikroadenoom võib põhjustada hüperprolaktineemilist hüpogonadismi, millega kaasneb libiido langus, erektsioonihäired, rindade suurenemine (günekomastia) ning näo ja keha karvade vähenemine.
Aktiivne mikroadeem, mis sekreteerib kortikotropiini (ACTH), viib neerupealise koore poolt toodetud steroidhormoonide (glükokortikoidide) liigse tekkeni, mis võib põhjustada hüpofüüsi etioloogiaga Itsenko-Cushingi tõbe.
Lastel võib selline mikroadenoom avalduda hüperkortitsismi (Cushingi sündroomi) sümptomitega, sealhulgas peavalud, üldine nõrkus, rasvkoe liigne ladestumine pagasiruumi, luu mineraalse tiheduse ja lihasjõu vähenemine, naha ribalaadne atroofia (lillade striiade kujul) jne.
Aktiivse somatotropiini tootva mikroadenoomi korral suureneb STH tase organismis. Lapsepõlves stimuleerib selle liigne anaboolne toime peaaegu kõigi keha luude kasvu ja võib viia gigantismi tekkeni; täiskasvanutel võib tekkida akromegaalia koos näoluude (põhjustades välimuse moonutamist) ja jäsemete liigeste kõhre suurenenud kasvuga (mis viib nende proportsioonide rikkumiseni ja sõrmede paksenemiseni), liigesevalu, liigse higistamise ja rasuerituse ning glükoositaluvuse häirega.
Väga harva (1–1,5% juhtudest) esineb hüpofüüsi mikroadenoom, mis toodab türeotropiini, ja kuna see hormoon stimuleerib kilpnääret, on patsientidel hüpofüüsi hüpertüreoidismi kliinilised tunnused siinustahhükardia ja südame kodade virvenduse, vererõhu tõusu, kehakaalu languse (suurenenud isuga) ning suurenenud närvilise erutuvuse ja ärrituvuse kujul.
Nn hüpofüüsi intrasellaarne mikroadenoom, sünonüüm - hüpofüüsi endosellaarne mikroadenoom, paikneb nagu kogu hüpofüüs kaare sees - koljupõhja kiiluluu anatoomilise sadulakujulise lohu sees. Samal ajal asub hüpofüüs selle lohu põhjas - hüpofüüsi lohus (intrasellaarne piirkond). Ja kogu terminite erinevus seisneb selles, et ladina keeles on "sees" intra ja kreeka keeles endom.
Kuid suprasellaarse kasvuga hüpofüüsi mikroadenoom tähendab, et kasvaja kasvab hüpofüüsi lohu põhjast ülespoole.
Hüpofüüsi tsüstiline mikroadenoom on suletud kotikese sarnase struktuuriga ja on asümptomaatiline moodustis.
Hüpofüüsi mikroadenoom koos hemorraagiaga võib olla apopleksia või hemorraagilise infarkti tagajärg, mis on seotud näärme suurenemise ja selle eesmise lobe parenhüümi sinusoidaalsete kapillaaride, neurohemaalsete sünapside ja/või portaalveresoonte kahjustusega.
Hüpofüüsi mikroadenoom ja rasedus
Nagu juba märgitud, on prolaktiini tootva hüpofüüsi mikroadenoomaga naised tavaliselt viljatud östrogeenipuuduse ja GnRH (gonadotropiini vabastava hormooni) pulseeriva sekretsiooni pärssimise tõttu. Rasedaks jäämiseks tuleb prolaktiini tase normaliseerida, vastasel juhul rasestumist ei toimu või rasedus katkeb juba alguses.
- Kas on võimalik sünnitada hüpofüüsi mikroadenoomiga?
Kliiniliselt funktsioneerivate mikroadeenoomidega naistel, keda ravitakse dopamiini agonistidega (kabergoliin või Dostinex), võib prolaktiini tase normaliseeruda ning menstruaaltsükkel ja viljakus taastuda.
Kas hüpofüüsi mikroadenoomi korral on võimalik imetada?
Sünnitusjärgsel perioodil on rinnaga toitmine lubatud, kui kasvaja sümptomeid ei esine, kuid on vaja jälgida selle suurust( kasutades aju magnetresonantstomograafiat).Ja kui kasvaja kasvab, lõpetatakse rinnaga toitmine.
- Hüpofüüsi mikroadenoom ja IVF
IVF-i puhul on vajalik hüperprolaktineemia ravi ning protseduuri saab alustada, kui normaalne prolaktiini tase on olnud stabiilne 12 kuud ja teiste hüpofüüsi hormoonide seerumitasemetes ei ole kõrvalekaldeid.
Tüsistused ja tagajärjed
Mis on hüpofüüsi mikroadenoomis ohtlik? Kuigi see kasvaja on healoomuline, võib selle esinemine põhjustada tüsistusi ja tagajärgi, eelkõige:
- viia hüpotaalamuse-hüpofüüsi-neerupealise süsteemi talitlushäireteni koos Itsenko-Cushingi tõve tekkega;
- häirida naiste menstruaaltsükli hormonaalset regulatsiooni ja põhjustada meestel erektsioonihäireid;
- põhjustada lastel kasvupeetust ja hüpofüüsi kääbuskasvu (hüpopituitarismi);
- provotseerida osteoporoosi arengut.
Kui kasvav kasvaja surub kokku nägemisnärvi kiude nende ristumiskohas (mis 80% inimestest asub otse hüpofüüsi kohal), tekib silmade liikuvuse häire (oftalmopleegia) ja perifeerse nägemise järkjärguline halvenemine. Kuigi mikroadeenoomid on tavaliselt sellise rõhu avaldamiseks liiga väikesed.
Kas hüpofüüsi mikroadenoom võib taanduda? See ei saa taanduda, kuid aja jooksul võib lastel esinev hormonaalselt inaktiivne kasvaja oluliselt väheneda. Kuid umbes 10%-l patsientidest võivad mikroadenoom suureneda.
Diagnostika hüpofüüsi mikroadenoomid
Hüpofüüsi mikroadenoomi diagnoosimiseks on vaja täielikku patsiendi anamneesi ja laboratoorseid uuringuid: vereanalüüsid hormoonide taseme määramiseks (toodetakse hüpofüüsi poolt), sealhulgas vereseerumi radioimmunoanalüüs prolaktiini taseme määramiseks.
Kui prolaktiini tase on normaalne ja esineb hüpofüüsi mikroadenoomi, siis on see kasvaja hormonaalselt passiivne. Aga kui esinevad prolaktinoomi sümptomid, võib selline vale-negatiivne tulemus olla kas laborikatse vea tagajärg või patsiendil on tekkinud makroadenoom, mis surub kokku hüpofüüsi varre.
Lisaks võib olla vajalik teha täiendavaid uuringuid, näiteks kilpnäärmehormoonide (T3 ja T4), immunoglobuliinide, interleukiin-6 taseme määramiseks vereseerumis.
Mikroadenoomi saab tuvastada ainult instrumentaalse diagnostika abil, kasutades aju magnetresonantstomograafiat (MRI). Mikroadenoomi MRI-d peetakse visualiseerimise standardiks, kusjuures kontrastaine võimendusega MRI tundlikkus on 90%.
Hüpofüüsi mikroadenoomi magnetresonantstomograafias (MRI) leitavad tunnused on järgmised: mikroadenoomi küljel asuva näärme maht; turjakõrvaseina (sella turcica) suuruse suurenemine; silmapõhja (alumise seina) hõrenemine ja kontuuri muutused; hüpofüüsi infundibulumi külgmine hälve; ümara ala isointensiivsus võrreldes halli ainega T1- ja T2-kaalutud piltidel; kerge hüperintensiivsus T2-kaalutud piltidel. [ 11 ]
Diferentseeritud diagnoos
Diferentsiaaldiagnostikat tehakse kraniofarüngioomi, hüpofüüsi granulaarse rakukasvaja (choristoma), Rathke kotikese tsüsti, dermoidse moodustumise, hüpofüüsi põletiku - autoimmuunse või lümfotsütaarse hüpofüsiidi, feokromotsütoomi, kilpnäärmehaiguste jne korral.
Anovulatoorse tsükliga naistel eristatakse hüpofüüsi mikroadenoome ja polütsüstiliste munasarjade sündroomi, kuna 75–90% ovulatsiooni puudumise juhtudest on polütsüstiliste munasarjade sündroomi tagajärg.
Kellega ühendust võtta?
Ravi hüpofüüsi mikroadenoomid
Hüpofüüsi adenoomide ja mikroadeenoomide ravi võib olla meditsiiniline ja kirurgiline. Samal ajal, kui kasvajad on asümptomaatilised, on soovitatav neid jälgida, st perioodiliselt teha MRI-uuringuid, et mitte maha magada nende suurenemise algust.
Konkreetse ravimi retsept määratakse patsiendi kasvaja tüübi põhjal.
PRL-i sekreteerivate kasvajate farmakoteraapia viiakse läbi hüpotalamuse D2-dopamiiniretseptorite stimulaatorite rühma kuuluvate ravimitega (selektiivsed dopamiini agonistid) ning kõige sagedamini kasutatavad on bromokriptiin (Parlodel, Bromergol), Norprolak ja tungaltera derivaat Cabergoline või Dostinex suurenenud prolaktiini sekretsiooniga hüpofüüsi mikroadenoomi korral.
Dostinexi (kabergoliin) kõrvaltoimete hulka võivad kuuluda allergilised reaktsioonid; peavalud ja pearinglus; iiveldus, oksendamine ja kõhuvalu; kõhukinnisus; nõrkus- või väsimustunne; unehäired. Bromokriptiini kõrvaltoimete hulka (lisaks allergilistele reaktsioonidele) kuuluvad valu rinnus; südame löögisageduse ja hingamise kiirenemine koos õhupuuduse tundega; vere köhimine; liigutuste koordinatsiooni halvenemine jne.
Kasvuhormooni eritavate mikro- ja makroadenoomide korral kasutatavad ravimid oktreotiid (Sandostatin), lanreotiid (Somatuline) ja pegvisomant on STH inhibiitorid ja selle retseptorite antagonistid.
Ja Itsenko-Cushingi sündroomiga adenohüpofüüsi AKTH-d sekreteerivate neoplasmade puhul kasutatakse metürapooni (metopürooni) või mitotaani (Lysodren).
Toimivate (hormonaalselt aktiivsete) mikroadenoomide korral tuleks kaaluda kirurgilist ravi. Juhtudel, kui konservatiivne ravi on ebaefektiivne ja kasvajal on turjakõrva sees kerge suprasellaarne laienemine, võib välja kirjutada hüpofüüsi adenomektoomia - operatsiooni hüpofüüsi mikroadenoomi eemaldamiseks. Praegu tehakse transnasaalset või transsfenoidaalset mikrodissektsiooni, st hüpofüüsi mikroadenoomi eemaldamist nina kaudu.
Hüpofüüsi mikroadenoomi eemaldamise võimalike tüsistuste ja tagajärgede hulka kuuluvad operatsioonijärgne verejooks ja tserebrospinaalvedeliku leke (mis sageli nõuab korduvoperatsiooni), samuti ajukelmete põletik, nägemishäired, hematoomide teke, mööduv diabeet insipidus ja mikroadenoomi kordumine.
Hüpofüüsi mikroadenoomi ja hüperprolaktineemia homöopaatias kasutatakse ravimeid, mille toime aitab sümptomeid osaliselt leevendada. Näiteks ebaregulaarse menstruatsiooni ja amenorröa korral on ette nähtud seepia tindi (Sepia) baasil valmistatud ravim ja niidu-karukelli (Pulsatilla) baasil valmistatud ravim ning galaktorröa korral Euroopa alpikanni juurel põhinev ravim.
Ilmselgelt ei tohiks loota, et hüpofüüsi mikroadenoomi rahvapärane ravi võib olla efektiivsem. Ja mitte ainult seetõttu, et selle diagnoosi puhul juhinduvad ravimtaimede spetsialistid ainult patsientide kaebustest (teadmata nende tegelikku etioloogiat), vaid ka paljude "rahvapäraste ravimite" ebausaldusväärsuse tõttu. Näidete otsimiseks pole vaja kaugele minna.
Mõned internetiallikad soovitavad prolaktiini taseme vähendamiseks kasutada priimula, ingverijuure ja seesamiseemnete segu. Kuid priimula aitab pikaajalise kuiva köha korral, vedeldab röga ja ingverijuur omab sarnaselt seesamiseemnetele laktogeenseid omadusi.
Samuti võib leida nõu võtta lurjuse tinktuuri. Tegelikkuses kasutatakse seda ravimit aga sisemiselt kõhupuhituse ja välispidiselt reumaatiliste liigesevalude korral. Suure tõenäosusega aeti lurjus segi musta lurjuse juurtega (selle teised nimetused on must lurjus ja must lurjus), mida kasutatakse menopausi ajal kuumahoogude korral.
Hüpofüüsi mikroadenoomi toitumine peaks olema tasakaalustatud - vähendatud suhkru ja soola tarbimisega. See ei ole eriline dieet, vaid lihtsalt vähem kalorsusega.
Hüpofüüsi mikroadenoomi korral on alkohol välistatud.
Millise arsti poole peaksin pöörduma hüpofüüsi mikroadenoomi korral? Endokrinoloogid, günekoloogid ja neurokirurgid tegelevad selle kasvajatüübiga seotud probleemidega.
Ärahoidmine
Kuna hüpofüüsi kasvajate keskkonna- või elustiilipõhjused on teadmata, ei ole hüpofüüsi mikroadeenoomide teket lihtsalt võimalik ära hoida.
Prognoos
Enamik hüpofüüsi kasvajaid on ravitavad. Kui hormonaalselt aktiivne hüpofüüsi mikroadenoom diagnoositakse õigeaegselt, on taastumise võimalused suured ja prognoos soodne.
Puue ja hüpofüüsi mikroadenoom: puue võib olla seotud kasvaja kasvu ja nägemisnärvi kahjustusega, samuti selle patoloogia muude tagajärgedega, mille raskusaste on individuaalne. Patsiendi puudeks tunnistamine sõltub olemasolevatest terviseprobleemidest ja funktsionaalsete häirete tasemest, mis peavad vastama seadusandlikult kinnitatud kriteeriumidele.
Hüpofüüsi ja sõjaväe mikroadenoom: selle kasvajaga patsiendid (isegi kui see on edukalt eemaldatud) ei tohiks üle kuumeneda, pikka aega päikese käes viibida ja end füüsiliselt üle koormata. Seega ei sobi nad sõjaväeteenistusse.
Kui kaua elavad inimesed hüpofüüsi mikroadenoomiga? See kasvaja ei ole vähk, seega pole eluea piiranguid. Kuigi aktiivse STH-d tootva mikroadenoomi korral võivad patsientidel tekkida hüpertensioon ja südame suuruse suurenemine ning see võib oluliselt lühendada nende eluiga. Itsenko-Cushingi tõve ja akromegaalia korral on üle 45-aastastel patsientidel suurenenud suremusrisk.

